题目内容
4.设N A为阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中含有的H +数为2NA | |
| C. | 常温常压下,46g NO2和N2O4的混合气体含有的原子数是3NA | |
| D. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA |
分析 A.依据方程式:2Na2O2+2CO2=2Na2CO3+O2,消耗2mol二氧化碳,转移2mol电子;
B.亚硫酸为弱电解质,部分电离;
C.NO2和N2O4中N和O原子比值都为1:2,则46g NO2和N2O4的混合气体中,含有的O原子质量为46g×$\frac{2×16}{2×16+14}$=32g,结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算.
D.求出钠的物质的量,然后根据反应后钠元素变为+1价来分析.
解答 解:A.标准状况下,5.6LCO2物质的量为 $\frac{5.6L}{22.4L/mol}$=0.25mol,依据方程式:2Na2O2+2CO2=2Na2CO3+O2,消耗2mol二氧化碳,转移2mol电子,所以转移电子数为:0.25 NA,故A错误;
B.亚硫酸是弱酸,在溶液中不能完全电离,故溶液中的氢离子的个数小于2NA个,故B错误;
C.NO2和N2O4中N和O原子比值都为1:2,则46g NO2和N2O4的混合气体中,含有的O原子质量为46g×$\frac{2×16}{2×16+14}$=32g,则n(O)=$\frac{32g}{16g/mol}$=2mol,n(N)=1mol,则46gNO2和N2O4的混合气体原子数是3NA,故C错误;
D.23g钠的物质的量为1mol,而反应后钠元素变为+1价,故1mol钠转移1mol电子即NA个,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的综合应用,熟练地运用与物质的量相关的计算公式,明确物质的结构是解题关键,注意氧化还原反应中电子转移数目的计算,题目难度不大.

练习册系列答案
相关题目
15.己知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法肯定正确的是( )
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中一定只含离子键 | |
| C. | W的氢化物与其最高正价氧化物对应水化物可以相互反应生成盐 | |
| D. | 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
16.下列关于乙烯的结构或性质叙述正确的是( )
| A. | 乙烯中所有原子都在同一个平面上 | B. | 不能在空气中燃烧 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 光照条件下与氯气发生取代反应 |
13.今有如下三个热化学方程式:
2H2(g)+O2(g)═2H2O(g) 放热Q1 kJ
2H2(g)+O2(g)═2H2O(l) 放热Q2 kJ
H2(g)+$\frac{1}{2}$O2(g)═H2O(g) 放热Q3kJ
其中Q1Q2Q3大小关系是( )
2H2(g)+O2(g)═2H2O(g) 放热Q1 kJ
2H2(g)+O2(g)═2H2O(l) 放热Q2 kJ
H2(g)+$\frac{1}{2}$O2(g)═H2O(g) 放热Q3kJ
其中Q1Q2Q3大小关系是( )
| A. | Q1=Q2=Q3 | B. | 2Q3=Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<3Q3 |


 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. .
.

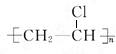 ,该反应类型是加聚反应
,该反应类型是加聚反应