题目内容
14.乙烯是石油化学工业最重要的基础原料,经乙烯为原料可以制得许多工业材料和日用品.乙烯能发生下列转化关系:
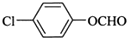
(1)A的分子为HCl,化合物D的官能团名称是羧基.
(2)写出反应③、⑤的化学方程式:
③n CH2=CHCl$\stackrel{引发剂}{→}$
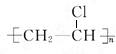 ,该反应类型是加聚反应
,该反应类型是加聚反应⑤CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(3)上述反应中,以生成有机产物为目标,原子利用率100%的反应有①和③④.
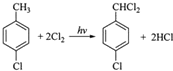
分析 乙烯与水发生加成反应生成B为CH3CH2OH,乙醇与D发生酯化反应生成乙酸乙酯,故D为CH3COOH.乙烯与氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷发生热裂解得到A与氯乙烯,则A为HCl,氯乙烯发生加聚反应生成聚氯乙烯,以此解答该题.
解答 解:乙烯与水发生加成反应生成B为CH3CH2OH,乙醇与D发生酯化反应生成乙酸乙酯,故D为CH3COOH.乙烯与氯气发生加成反应生成1,2-二氯乙烷,1,2-二氯乙烷发生热裂解得到A与氯乙烯,则A为HCl,氯乙烯发生加聚反应生成聚氯乙烯,
(1)由上述分析可知,A的分子为HCl,化合物D为CH3COOH,官能团名称是:羧基,故答案为:HCl;羧基;
(2)氯乙烯发生加聚反应生成聚氯乙烯,反应化学方程式为:n CH2=CHCl$\stackrel{引发剂}{→}$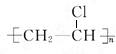 ,
,
反应⑤为乙醇、乙酸的酯化反应,方程式为CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:n CH2=CHCl$\stackrel{引发剂}{→}$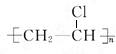 ;加聚反应;CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
;加聚反应;CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(3)加成反应中原子利用率为100%,上述反应中①③④属于加成反应,以生成有机产物为目标,原子利用率100%的反应有①和③④,故答案为:③④.
点评 本题考查有机物推断、为高考常见题型,侧重于学生的分析能力的考查,题目涉及石油化工、烯烃、醇、羧酸的性质与转化,题目基础性强,注意对基础知识的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.设N A为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中含有的H +数为2NA | |
| C. | 常温常压下,46g NO2和N2O4的混合气体含有的原子数是3NA | |
| D. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA |
5.下列仪器中不能发生化学反应的是( )
| A. |  | B. |  | C. |  | D. |  |
2. 用已知浓度的NaOH溶液测定某草酸【H2C2O4】溶液的浓度,参考图,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定某草酸【H2C2O4】溶液的浓度,参考图,从下表中选出正确选项( )
 用已知浓度的NaOH溶液测定某草酸【H2C2O4】溶液的浓度,参考图,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定某草酸【H2C2O4】溶液的浓度,参考图,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 酚酞 | (乙) |
| C | 碱 | 酸 | 甲基橙 | (甲) |
| D | 酸 | 碱 | 酚酞 | (甲) |
| A. | A | B. | B | C. | C | D. | D |
9.下列说法不正确的是( )
| A. | C2H4的摩尔质量与6.02×1023个氮分子的质量在数值上相等 | |
| B. | 0.5mol二氧化氮和6.02×1023个氢分子的质量比等于23:2 | |
| C. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| D. | 0.5×6.02×1023个二氧化碳分子所占体积是11.2 L |
3.现有a、b、c、d四种金属,①a、b合金铸造的日用品暴露在潮湿空气中a先被腐蚀;②电解b、c的硫酸盐混合溶液,电极上金属c析出后再析出b;③d的硝酸盐溶液呈中性,四种金属活泼性由强到弱的顺序是( )
| A. | d、a、b、c | B. | d、b、a、c | C. | a、b、c、d | D. | a、b、d、c |
 ;
; ;
; ;
; (写结构简式).
(写结构简式).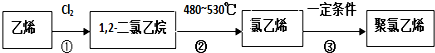
 ,反应类型为加聚反应;
,反应类型为加聚反应; ;MgF2
;MgF2 .
. 和
和
