题目内容
7.化学与生产、生活、环境、社会密切相关,下列有关说法中不正确的是( )| A. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| B. | 使用加酶洗衣粉,水温越高,洗涤效果更好 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 国务院要求坚决控制钢铁、水泥、焦炭等高耗能行业产能总量,是落实“低碳经济”的具体举措 |
分析 A.生物防治技术能减少粮食的污染;
B.高温蛋白质会变性;
C.利用CO2合成聚碳酸酯类可降解塑料,减少二氧化碳的排放;
D.钢铁、水泥、焦炭等行业高耗能、高排放.
解答 解:A.农药使用会污染环境,则大力推广农作物的生物防治技术,以减少农药的使用,故A正确;
B.酶的催化应控制在一定温度范围之内,防止温度过高而导致蛋白质变性,失去催化功能,故B错误;
C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用应用,减少二氧化碳的排放,故C正确;
D.钢铁、水泥、焦炭等行业高耗能、高排放,控制钢铁、水泥、焦炭等行业产能总量能节能减排,落实“低碳经济”,故D正确;
故选B.
点评 本题考查学生关注化学与工农业生产、日常生活、社会热点问题,为高考常见题型,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
3.将5.6g Fe全部溶于200mL一定浓度的硝酸溶液中,得到标准状况下的气体2.24L,又测得反应后溶液中H+的浓度为0.2mol•L-1(设反应前后溶液体积的变化忽略不计).下列说法不正确的是( )
| A. | 2.24 L气体是NO | |
| B. | 反应后Fe全部转化为Fe3+ | |
| C. | 反应后的溶液中c(NO3-)=1.7 mol•L-1 | |
| D. | 反应后的溶液最多还能再溶解2.24 g Fe |
15.下列说法正确的是( )
| A. | 为了防止富脂食品氧化变质,延长食品的保质期,常在包装袋中放入生石灰 | |
| B. | 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 | |
| C. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
2.化学与生产、生活紧密相关,下列物质的性质和用途均正确且有因果关系的是( )
| 选项 | 性质 | 用途 |
| A | 糖类、油脂和蛋白质均能水解 | 供给人类营养 |
| B | 铁能被浓硫酸钝化 | 铁制器皿用作铜和浓硫酸的反应容器 |
| C | 碳单质的还原性强于硅单质 | 碳与石英反应冶炼粗硅 |
| D | 常温下,氨气能与氯气反应 | 浓氨水检验氯气管道泄漏 |
| A. | A | B. | B | C. | C | D. | D |
12.对下列各种溶液中所含微粒的判断合理的是( )
| A. | 在银氨溶液中可大量含有:Cu2+、K+、Cl-、SO42- | |
| B. | 使甲基橙试液变红色的溶液中可大量含有:K+,Na+,S2-,SO32- | |
| C. | 室温下,pH=12的碱性溶液中一定没有CH3COOH分子 | |
| D. | 在c(H+)=10-14mol/L的溶液中可大量含有:Na+,AlO2-,CO32-,SO42- |
1.水煤气法制甲醇工艺流程框图如图:
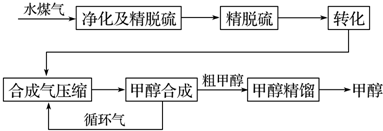
已知:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为C(s)+H2O(g)?CO(g)+H2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$;
②下列能提高碳的平衡转化率的措施是BC.
A加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=-519kJ.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同).
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ.4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正>v逆(填“>”、“<”或“=”).
②若加入同样多的CO、H2,在T5℃反应,10min后达到平衡,此时c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•L-1•min-1.
(4)生产过程中,合成气要进行循环,其目的是提高原料利用率(或提高产量、产率亦可).

已知:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成.
(1)制水煤气的主要化学反应方程式为C(s)+H2O(g)?CO(g)+H2(g),此反应是吸热反应.
①此反应的化学平衡常数表达式为$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$;
②下列能提高碳的平衡转化率的措施是BC.
A加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为CH4(g)+$\frac{3}{2}$O2(g)?CO(g)+2H2O(g)△H=-519kJ.工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同).
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是Z(填“X”或“Y”或“Z”),选择的理由是催化活性高、速度快、反应温度较低.
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g)+CO(g)?CH3OH(g)△H=-181.6kJ.4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
②若加入同样多的CO、H2,在T5℃反应,10min后达到平衡,此时c(H2)=0.4mol•L-1,则该时间内反应速率v(CH3OH)=0.03mol•L-1•min-1.
(4)生产过程中,合成气要进行循环,其目的是提高原料利用率(或提高产量、产率亦可).
18.下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终得到纯净物的是( )
| A. | 向NaHCO3溶液中加入过量的Na2O2粉末 | |
| B. | 向KI和NaBr混合溶液中通入过量的Cl2 | |
| C. | 向NaAlO2溶液中加入过量的HCl溶液 | |
| D. | 将物质的量相同的(NH4)2SO4溶液和BaCl2溶液混合 |
 磷及其化合物在生产生活中的用途非常广泛.回答下列问题:
磷及其化合物在生产生活中的用途非常广泛.回答下列问题: