题目内容
14.下面的排序不正确的是( )| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔点由高到低:Na>Mg>Al | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 四种气态氢化物按稳定性:SiH4<CH4<H2O<HF |
分析 A.均为分子晶体,相对分子质量大的熔点高;
B.均为金属晶体,离子半径小、电荷高的熔点高;
C.均为原子晶体,原子半径小的硬度大;
D.非金属性越强,氢化物越稳定.
解答 解:A.均为分子晶体,相对分子质量大的熔点高,则晶体熔点由低到高:CF4<CCl4<CBr4<CI4,故A正确;
B.均为金属晶体,离子半径小、电荷高的熔点高,则熔点由高到低:Al>Mg>Na,故B错误;
C.均为原子晶体,原子半径小的硬度大,则硬度由大到小:金刚石>碳化硅>晶体硅,故C正确;
D.非金属性越强,氢化物越稳定,则气态氢化物的稳定性:SiH4<CH4<H2O<HF,故D正确;
故选B.
点评 本题考查晶体及性质,为高频考点,把握晶体类型的判断、物质性质比较方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
20. 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.
Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:C02(g)+3H2(g)?CH3OH(g)+H20(g)△H几种化学键的键能如表所示
通过计算得出△H=-2208kJ/mol.
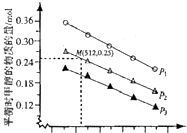
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该由池由储500mLImol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
(1)海水经初步处理后,还含有Ca2+、Mg2+,Na+、CL-,向其中加入石灰浆使海水中的Mg2+转换 为Mg(OH)2,当Mg2+刚好沉淀完全时,c( Ca2+)为4.58mol/L
已知Ksp[Mg(OH)2]=1.2xl0-11 Ksp[Ca(OH)2]=5.5X10-6
(2)处理过的废气中S02的含量可以通过碘暈法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中S02的含量$\frac{0.224}{at}$(用含a,t的式子表示)
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:C02(g)+3H2(g)?CH3OH(g)+H20(g)△H几种化学键的键能如表所示
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该由池由储500mLImol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
已知Ksp[Mg(OH)2]=1.2xl0-11 Ksp[Ca(OH)2]=5.5X10-6
(2)处理过的废气中S02的含量可以通过碘暈法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中S02的含量$\frac{0.224}{at}$(用含a,t的式子表示)
5.下列说法不正确的是( )
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |
9.下列反应能用离子方程式CO32-+Ba2+═BaCO3↓表示的有( )
| A. | BaCl2与K2CO3溶液反应 | B. | CO2与Ba(OH)2溶液反应 | ||
| C. | Ba(NO3)2与Na2CO3溶液反应 | D. | Ba(OH)2与少量NaHCO3溶液反应 |
19.对于反应2SO2+O2$?_{加热}^{催化剂}$2SO3,下列判断正确的是( )
| A. | 达到反应限度时SO2的消耗速率必定等于SO3的生成速率相等 | |
| B. | 平衡时SO2、O2、SO3的分子数之比为2:1:2 | |
| C. | 平衡时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 若反应在恒容容器中进行,气体密度保持不变,可以判定反应到达平衡 |
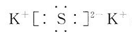 ,A属于离子化合物.
,A属于离子化合物. 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题: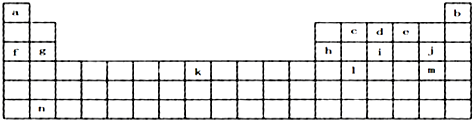
 ,元素c在周期表的位置第二周期IVA族
,元素c在周期表的位置第二周期IVA族