题目内容
7.表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):| 物质 | Cl2 | Br2 | I2 | H2 | HCl | HI | HBr |
| 键能/(kJ•mol-1) | 243 | 193 | 151 | 436 | 431 | 298 | 366 |
| A. | Cl2 | B. | Br2 | C. | I2 | D. | 无法判断 |
分析 破坏1mol物质中的化学键所消耗的能量越高,生成物越稳定,发生该反应放出的热量越多,以此来解答.
解答 解:由表格数据可知,X2中Cl2的键能最大,生成物中HCl的键能最大,HCl最稳定,则当消耗等物质的量的氢气时,Cl2与氢气反应放出热量最多,
故选A.
点评 本题考查反应热,为高频考点,把握反应中能量变化、键能与稳定性的关系为解答的关键,侧重分析与应用能力的考查,注意数据的应用,题目难度不大.

练习册系列答案
相关题目
17.某烃的键线式结构为 ,该烃与Br2按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)( )
,该烃与Br2按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)( )
 ,该烃与Br2按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)( )
,该烃与Br2按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.把6mol气体A和5mol气体B通入容积为4L的密闭容器中,在一定条件下发生如下反应:3A(g)+B(g)?2C(g)+xD(g)(正反应放热),5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol•L-1•min-1.下列说法中正确的是( )
| A. | A的平均反应速率为0.15mol•L-1•min-1 | |
| B. | 恒温下达到平衡的标志是C和A的生成速率相等 | |
| C. | 降低平衡体系的温度,逆反应速率变小,正反应速率增大 | |
| D. | B的转化率为25% |
2.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成碳酸钠、碳酸氢钠 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
12.短周期元素a、b、c、d原子序数依次增大.a的核外电子总数与其周期数相同,b的某种单质是空气的主要成分,c的最外层电子数为其内层电子数的3倍,d与c同族;下列说法错误的是( )
| A. | a、b、d均可以与c形成两种或多种二元化合物 | |
| B. | 阴离子的还原性d大于c | |
| C. | a与d形成的化合物可以抑制水的电离 | |
| D. | 常温下,由这四种元素构成的某种盐的溶液pH=4,则水电离出的H+浓度肯定是1×10-4mol/L |
19.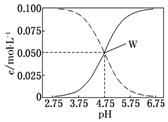 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )| A. | pH=5.75的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=7,c(Na+)=0.1 mol•L-1,c( CH3COOH)>c(Na+)=c( CH3COO-)>c(H+)=c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
16.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | l mol OH-所含电子数为10NA | |
| B. | 2L0.5 mol•L-1Na2SO4溶液中阴离子所带电荷数为0.2NA | |
| C. | 标准状况下,1.12 L CC14含有的氯原子数为0.2NA | |
| D. | 14 g由CO和N2组成的混合气体中含有的分子总数为NA |
17.下列物质只能作还原剂的是( )
| A. | S2- | B. | Fe2+ | C. | SO32- | D. | K+ |


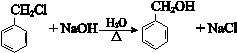 .
.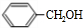 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2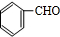 +2H2O.
+2H2O. .
.