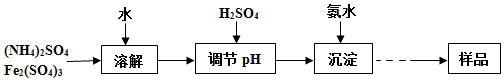
题目内容
7.把下列四种X溶液分别加入盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )| A. | 10℃20 mL 3 moL•L-1的X溶液 | B. | 10℃10 mL 2 moL•L-1的X溶液 | ||
| C. | 20℃10 mL 5 moL•L-1的X溶液 | D. | 20℃30 mL 2 moL•L-1的X溶液 |
分析 先计算出稀释后X溶液的中X的物质的量,最后溶液的体积都为50mL,则物质的量越大,浓度越大,则反应速率越大;并结合温度越高,反应速率越大来判断.
解答 解:A.10℃20 mL 3 moL•L-1的X溶液,X的物质的量为0.02L×3mol/L=0.06mol,
B.10℃10 mL 2 moL•L-1的X溶液,X的物质的量为0.01L×2mol/L=0.02mol,
C、20℃10 mL 5 moL•L-1的X溶液,X的物质的量为0.01L×5mol/L=0.05mol,
D、20℃30ml 2mol/L的X溶液,X的物质的量为0.03L×2mol/L=0.06mol,
显然四种情况下D中温度最高,浓度最大,所以反应速率是最大,
故选D.
点评 本题考查反应速率与温度、浓度的关系及物质的量的计算,难度不大.明确影响化学反应速率的因素、物质的量与浓度的关系是解答本题的关键.

练习册系列答案
相关题目
14.下列关于溶液酸碱性的说法正确的是( )
| A. | pH=7的溶液呈中性 | B. | 中性溶液中一定有c(H+)=10-7mol/L | ||
| C. | c(H+)=c(OH-)的溶液呈中性 | D. | 在100℃时,纯水的pH<7,因此呈酸性 |
12.已知叠氮酸(HN3)的Ka=10-4.7.下列有关0.1mol•L-1的NaN3溶液中离子浓度的大小关系不正确的是( )
| A. | c(Na+)>c(N3-) | B. | c(N${\;}_{3}^{-}$)>c(OH-) | ||
| C. | c(H+)>c(OH-) | D. | c(Na+)=c(N${\;}_{3}^{-}$)+c(HN3) |
2.已知1mol白磷完全转化为红磷放出29.2kJ热量,下列两个反应:P4(白,s)+5O2(g)═2P2O5(s)△H=-Q1,4P(红,s)+5O2(g)═2P2O5(s)△H=-Q2,Q1与Q2的关系是( )
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法确定 |
19.“毒胶囊”泛指利用由工业皮革废料为原料生产的含重金属铬(Cr)超标的胶囊,其中含有可能引起人体肾伤害的+6 价的铬.下列铬的化合物中铬呈+6 价的是( )
| A. | Cr2(SO4)3 | B. | Cr2O3 | C. | K2Cr2O7 | D. | Cr(OH)3 |
17.在盛放浓硫酸的试剂瓶标签上应该印有下列警示标记中的( )
| A. |  爆炸品 | B. |  易燃液体 | C. |  剧毒品 | D. |  腐蚀品 |