题目内容
14.下列关于溶液酸碱性的说法正确的是( )| A. | pH=7的溶液呈中性 | B. | 中性溶液中一定有c(H+)=10-7mol/L | ||
| C. | c(H+)=c(OH-)的溶液呈中性 | D. | 在100℃时,纯水的pH<7,因此呈酸性 |
分析 根据c(H+)、c(OH-)的相对大小判断溶液的酸碱性,若c(H+)=c(OH-)为中性,c(H+)>c(OH-)为酸性,c(H+)<c(OH-)为碱性,以此来解答.
解答 解:A.pH=7可能为碱性,如100℃时pH=6为中性,故A不选;
B.100℃时pH=6为中性,则中性溶液中可能有c(H+)=10-6mol/L,故B不选;
C.c(H+)=c(OH-)的溶液,一定呈中性,故C选;
D.在100℃时,纯水的pH<7,但c(H+)=c(OH-),为中性,故D不选;
故选C.
点评 本题考查溶液酸碱性的判断,为高频考点,把握pH与温度的关系、酸碱性的判断方法为解答的关键,侧重分析与应用能力的考查,注意温度对Kw的影响,题目难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
4.下列做法不利于金属防护的是( )
| A. | 切菜刀切菜后不洗净就放回刀架 | B. | 将钢铁制成不锈钢 | ||
| C. | 在铁塔的表面喷漆 | D. | 埋在地下的钢管与锌块连接 |
2.下列实验可达到实验目的是( )
| A. | 将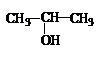 与NaOH的水溶液共热制备CH3-CH═CH2 与NaOH的水溶液共热制备CH3-CH═CH2 | |
| B. | 用甲苯与稀硝酸、稀硫酸的混合酸相混制取TNT | |
| C. | 甲苯在溴化铁催化作用下与液溴反应生成2,4,6-三溴甲苯 | |
| D. | 向CH3CH2Br中滴入AgNO3溶液就可以检验溴元素 |
9.(1)次磷酸(H3PO2)是一种一元中强酸,重要的精细化工产品.
①写出次磷酸的电离方程式:H3PO2?H++H2PO2-.
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH-)-c(H3PO2)=10-7mol/L.(用具体数值表示)
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表,
上述盐溶液中的阴离子,结合H+能力最强的是CO32-.根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,PH变化最大的是C(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3.
①写出次磷酸的电离方程式:H3PO2?H++H2PO2-.
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH-)-c(H3PO2)=10-7mol/L.(用具体数值表示)
(2)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如表,
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3.
19.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 不需加热就能发生的反应一定是放热反应 | |
| C. | 反应物总能量高于生成物总能量的反应一定是放热反应 | |
| D. | 破坏反应物中的化学键所吸收的总能量多于形成生成物中化学键所放出的总能量的反应一定是放热反应 |
6.现代居室空气污染,主要来源是化纤地毯、装饰材料、油漆家俱等释放出的主要污染物是( )
| A. | CH4 | B. | CO | C. | CO2 | D. | HCHO |
3.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是( )
| A. | 偏二甲肼的摩尔质量为60g | |
| B. | 6.02×1023个偏二甲肼分子的质量约为60g | |
| C. | 1mol偏二甲肼的质量为60g/mol | |
| D. | 6g偏二甲肼含有1.2NA个偏二甲肼分子 |
7.把下列四种X溶液分别加入盛有10mL 2mol•L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
| A. | 10℃20 mL 3 moL•L-1的X溶液 | B. | 10℃10 mL 2 moL•L-1的X溶液 | ||
| C. | 20℃10 mL 5 moL•L-1的X溶液 | D. | 20℃30 mL 2 moL•L-1的X溶液 |