题目内容
3.有机化合物甲: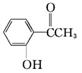 乙:
乙: ,丙:
,丙: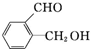
(1)请写出丙中含氧官能团的名称醛基、羟基.
(2)请判断上述哪些化合物互为同分异构体:甲、乙、丙互为同分异构体.
(3)请分别写出鉴别甲、乙、丙化合物的方法:(指明所选试剂及主要现象即可)
鉴别甲的方法:与FeCl3溶液发生显色反应的是甲;
鉴别丙的方法:与银氨溶液作用会发生银镜反应的是丙.
(4)请按酸性由强到弱排列甲、乙、丙的顺序:乙>甲>丙.
分析 (1)丙含有羟基和醛基;
(2)三种有机物的分子式相同,结构不同;
(3)甲含有酚羟基,丙含有醛基;
(4)羧基的酸性大于酚羟基,醇、醛不具有酸性.
解答 解:(1)由结构简式可知丙含有羟基和醛基,故答案为:醛基、羟基;
(2)三种有机物的分子式相同,结构不同,都为同分异构体,故答案为:甲、乙、丙互为同分异构体;
(3)甲含有酚羟基,可与氯化铁发生显色反应,溶液变紫色,丙含有醛基,与银氨溶液作用会发生银镜反应,
故答案为:与FeCl3溶液发生显色反应的是甲;与银氨溶液作用会发生银镜反应的是丙;
(4)羧基的酸性大于酚羟基,醇、醛不具有酸性,则酸性乙>甲>丙,故答案为:乙>甲>丙.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
13.下列选项中,跟其他选项属于不同类别的是( )
| A. | 蒸馏 | B. | 萃取 | C. | 蒸发 | D. | 中和 |
14.下图装置或操作正确的是( )
| A. |  用装置量取 15.00ml 的 NaOH 溶液 | |
| B. |  用装置制备 Cl2 | |
| C. |  装置用于除去 CO2中的HCl | |
| D. |  关闭活塞 a,从 b处加水,以检查装置的气密性 |
11.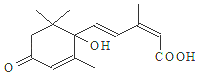 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1mol该物质与H2加成,最多消耗5molH2 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
18.下列说法正确的是( )
| A. | 容量瓶和分液漏斗使用前必须要检漏、干燥 | |
| B. | 可以用酒精萃取溶解在水中的碘 | |
| C. | 新制氯水应保存在棕色细口瓶中 | |
| D. | 某溶液焰色反应呈黄色,说明溶液中含有Na+,不含K+ |
8.高二(3)班某小组同学做完铜、锌-稀硫酸实验后,在读书卡片上记录如下:

卡片上的描述合理的是( )

卡片上的描述合理的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
15.某研究性学习小组查阅资料收集到如下信息:铁盐能蚀刻银而用来制作液晶显示器的银线路板.他们对蚀刻银的过程进行了探究.
【实验1】制备银镜:
(1)ⅰ.配制银氨溶液,需要的试剂是AgNO3溶液、稀氨水.并取等量银氨溶液于多支试管中.
ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
(2)选用Fe2(SO4)3溶液的浓度为0.05mol/L,目的是保证c(Fe3+)相等.
(3)从a、b中均检出了Fe2+,说明Fe3+具有氧化性.a中Fe3+氧化Ag的离子方程式
是Fe3++Ag═Fe2++Ag+.
(4)确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中SO42-的方法是取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀.
(5)推测在a中的酸性条件下NO3-氧化了银,证据是a中溶液黄色略变浅,b中溶液黄色明显变浅.通过如下实验验证了推测是合理的:
ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液:配制pH=2,c(NO3-)=0.3mol/L的溶液.取5mL此溶液加入有银镜的试管,现象是银镜消失,溶液颜色无明显变化.
请将步骤ⅱ补充完整.
(6)分析a中白色沉淀的成分,提出假设.
假设1:Fe(OH)2; 假设2:AgNO2; 假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
【实验结论与讨论】铁盐能蚀刻银;NO3-能提高铁盐的蚀刻能力.推测硝酸铁溶液如果保持足够的酸性,可以避免产生沉淀.
【实验1】制备银镜:
(1)ⅰ.配制银氨溶液,需要的试剂是AgNO3溶液、稀氨水.并取等量银氨溶液于多支试管中.
ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
(3)从a、b中均检出了Fe2+,说明Fe3+具有氧化性.a中Fe3+氧化Ag的离子方程式
是Fe3++Ag═Fe2++Ag+.
(4)确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中SO42-的方法是取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀.
(5)推测在a中的酸性条件下NO3-氧化了银,证据是a中溶液黄色略变浅,b中溶液黄色明显变浅.通过如下实验验证了推测是合理的:
ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液:配制pH=2,c(NO3-)=0.3mol/L的溶液.取5mL此溶液加入有银镜的试管,现象是银镜消失,溶液颜色无明显变化.
请将步骤ⅱ补充完整.
(6)分析a中白色沉淀的成分,提出假设.
假设1:Fe(OH)2; 假设2:AgNO2; 假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
| 实验方案 | 预期现象和结论 |
12.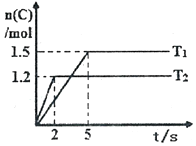 现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
 现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )| A. | T1<T2 | |
| B. | 该反应在温度为T1时达到平衡时,容器中A与C的物质的量浓度相等 | |
| C. | 温度为T2时,2s内B的平均速率为0.3mol•L-1•s-l | |
| D. | 温度为T1时,达平衡时反应物A的转化率为60% |
13.下列操作实验操作、现象、解释或结论都正确的是( )
| 操作 | 现象 | 解释或结论 | |
| A | 充分浸透了 Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可用作木材防火剂 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中有Na+、无K+ |
| C | 分别向含有酚酞的烧碱溶液中通入氯气、二氧化硫 | 溶液颜色都变淺 | 说明氯气和二氧化硫都有 漂白性 |
| D | 向某加碘食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐中一定没有添加 KIO3 |
| A. | A | B. | B | C. | C | D. | D |