题目内容
今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A. ①>②>③B.①<②<③C.①=②=③E.①>②=③
D.①=③>②F.①<②=③G.①=②<③H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是 .
(2)当它们的物质的量浓度相同时,其pH的关系是 .
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为 .
(4)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 .
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 .
A. ①>②>③B.①<②<③C.①=②=③E.①>②=③
D.①=③>②F.①<②=③G.①=②<③H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是
(2)当它们的物质的量浓度相同时,其pH的关系是
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为
(4)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)pH=-lgc(H+),浓度相同,溶液pH大小由溶液中氢离子浓度大小分析计算判断;
(2)pH相同溶液中氢离子浓度相同,依据醋酸是弱酸,硫酸是二元酸分析判断;
(3)中和等量氢氧化钠,依据化学方程式中的电离关系计算判断;
(4)溶液中溶质物质的量相同时,与碱反应后溶液呈中性,硫酸是二元酸,醋酸是弱酸分析判断;
(5)根据硫酸和盐酸为强酸,溶液中完全电离,醋酸为弱电解质,溶液中部分电离.
(2)pH相同溶液中氢离子浓度相同,依据醋酸是弱酸,硫酸是二元酸分析判断;
(3)中和等量氢氧化钠,依据化学方程式中的电离关系计算判断;
(4)溶液中溶质物质的量相同时,与碱反应后溶液呈中性,硫酸是二元酸,醋酸是弱酸分析判断;
(5)根据硫酸和盐酸为强酸,溶液中完全电离,醋酸为弱电解质,溶液中部分电离.
解答:
解:(1)当它们pH相同时,溶液中氢离子浓度相同,假设提供1mol/L的氢离子,需要醋酸浓度应大于1mol/L,需要氯化氢溶液浓度为1mol/L,需要H2SO4溶液浓度为0.5mol/L;其物质的量浓度由大到小排列的是:①>②>③,故答案为:A;
(2)当它们的物质的量浓度相同时,CH3COOH是弱酸部分电离,氢离子浓度最小;HCl是强酸完全电离,电离的氢离子大于醋酸;H2SO4是二元强酸,电离的氢离子浓度大于氯化氢,根据pH=-lgc(H+)可知,溶液的pH由大到小排列的是①>②>③,故答案为:A;
(3)中和相同体积、相同物质的量浓度的烧碱溶液,假设氢氧化钠物质的量为1mol,需要①醋酸1mol,需要②HCl 1mol;需要③H2SO4 0.5mol;需相同物质的量浓度的三种酸溶液的体积大小关系为:①=②>③,
故答案为:H;
(4)体积和浓度相同的①、②、③三溶液,假设溶质为1mol,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,①CH3COOH是弱酸,恰好中和生成醋酸钠溶液呈碱性,所以需要烧碱小于1mol;②氯化氢和1mol氢氧化钠恰好反应溶液呈中性;③1molH2SO4和2mol恰好反应需要氢氧化钠2mol,所需烧碱溶液的体积由大到小关系为:①<②<③,故答案为:B;
(5)当它们的pH相同体积相同时,同时加入足量锌,若产生相同体积的气体(相同状况),硫酸和盐酸为强酸,PH相同,溶液中氢离子浓度相等,二者与锌反应生成氢气的速率相等;而醋酸溶液中氢离子浓度减小,醋酸的电离程度增大,因此醋酸溶液中产生氢气的反应速率大于硫酸和盐酸的速率,所以反应时间大小关系为:①<②=③,
故答案为:F.
(2)当它们的物质的量浓度相同时,CH3COOH是弱酸部分电离,氢离子浓度最小;HCl是强酸完全电离,电离的氢离子大于醋酸;H2SO4是二元强酸,电离的氢离子浓度大于氯化氢,根据pH=-lgc(H+)可知,溶液的pH由大到小排列的是①>②>③,故答案为:A;
(3)中和相同体积、相同物质的量浓度的烧碱溶液,假设氢氧化钠物质的量为1mol,需要①醋酸1mol,需要②HCl 1mol;需要③H2SO4 0.5mol;需相同物质的量浓度的三种酸溶液的体积大小关系为:①=②>③,
故答案为:H;
(4)体积和浓度相同的①、②、③三溶液,假设溶质为1mol,分别与同浓度的烧碱溶液反应,要使反应后溶液的pH为7,①CH3COOH是弱酸,恰好中和生成醋酸钠溶液呈碱性,所以需要烧碱小于1mol;②氯化氢和1mol氢氧化钠恰好反应溶液呈中性;③1molH2SO4和2mol恰好反应需要氢氧化钠2mol,所需烧碱溶液的体积由大到小关系为:①<②<③,故答案为:B;
(5)当它们的pH相同体积相同时,同时加入足量锌,若产生相同体积的气体(相同状况),硫酸和盐酸为强酸,PH相同,溶液中氢离子浓度相等,二者与锌反应生成氢气的速率相等;而醋酸溶液中氢离子浓度减小,醋酸的电离程度增大,因此醋酸溶液中产生氢气的反应速率大于硫酸和盐酸的速率,所以反应时间大小关系为:①<②=③,
故答案为:F.
点评:本题考查了弱电解质的电离,明确弱酸存在电离平衡、一元强酸和二元强酸反应中存在定量关系即可解答,注意不同的酸和同一种金属反应时其反应速率与氢离子浓度成正比,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
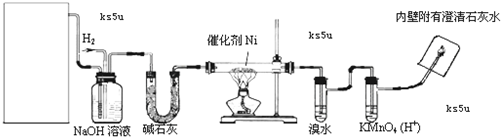
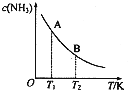 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: