题目内容
11.KO2的晶体结构和NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-的位置用O2-代替,则关于KO2晶体结构的描述正确的是( )| A. |  如图一个超氧化钾小晶胞中含有4个KO2 | |
| B. | 和K+距离相同且最近的O2-构成的多面体是正六面体 | |
| C. | 和K+距离相同且最近的K+有8个 | |
| D. | 和K+距离相同且最近的O2-共有8个 |
分析 A、根据均摊法进行计算;
B、以顶点上K+的为例,和K+距离相同且最近的O2-位于经过该顶点的棱边的中点;
C、以顶点上K+的为例,和K+距离相同且最近的K+-位于经过该顶点的面的面心上;
D、以顶点上K+的为例,和K+距离相同且最近的O2-位于经过该顶点的棱边的中点.
解答 解:A、K+位于晶胞棱心和体心,数目为12×$\frac{1}{4}$+1=4,O2-位于顶点和面心,数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即一个KO2晶胞中摊得的K+和O2-粒子数均为4个,故A正确;
B、与K+距离相等且最近的O2-共有6个,构成正八面体,K+位于正八面体中心,故B错误;
C、K+位于晶胞棱心,则被横平面、竖平面和正平面共有,且每一个平面有4个K+距离最近,共4×3=12个,故C错误;
D、K+位于晶胞棱心,与K+距离相等且最近的O2-位于顶点和面心,共有6个,故D错误;
故选A.
点评 本题考查晶胞计算和配位数,难度不大,要求学生有一定的空间想象能力.

练习册系列答案
相关题目
2.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性.现有以下反应( )
①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,
下列说法正确的是.
| A. | 上述三个反应都有单质生成,所以都是置换反应 | |
| B. | 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
19.下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应,都产生H2的是( )
| A. | 核内无中子的原子 | |
| B. | 价电子构型为3s23p1 | |
| C. | 最外层电子数等于倒数第三层上的电子数的原子 | |
| D. | N层上无电子,最外层上的电子数等于电子层数的原子 |
6.将一定质量的铁投入20mL浓硫酸中,加热充分反应后固体有剩余并收集气体4.48L(标准状况),质量为6.6g;则
(1)参加反应的铁的质量为11.2g.
(2)硫酸溶液的物质的量浓度为15mol/L.
(1)参加反应的铁的质量为11.2g.
(2)硫酸溶液的物质的量浓度为15mol/L.
20.用下列实验装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 | 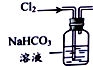 | 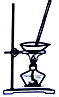 | 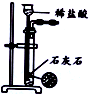 | 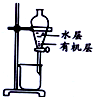 |
| 目的 | 除去Cl2中含有的少量HCl | 蒸发NaCl饱和溶液制备NaCl晶体 | 制取少量纯净的CO2气体 | 分离酒精和水的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |

 .
.


 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O 、
、 .
.