题目内容
16.据报道,苹果醋是由苹果发酵而成的酸性饮品,其中的酸性物质主要是苹果酸.有关苹果酸的结构确定及合成过程如下:Ⅰ、苹果酸的结构确定
[1]苹果酸在分离提纯后的化学分析如下:苹果酸中只含有C、H、O三种元素,其中氧元素的质量分数为59.7%,且其相对分子质量大于112小于160.请推断苹果酸中的氧原子个数为5,分子式为C4H6O5.
[2]已知1mol苹果酸与足量的NaHCO3反应放出44.8LCO2,与足量的Na反应放出33.6LH2(气体体积均已折算为标准状况);核磁共振氢谱显示苹果酸中存在5种不同环境的H原子.
(1)一个苹果酸分子中有1个-OH;
(2)写出苹果酸的结构简式
 .
.Ⅱ、苹果酸的人工合成路线如下:
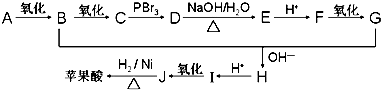
已知:75%(体积分数)的A水溶液常用于医疗消毒,其中R、R1、R2可以是烃基或氢原子;
①

②

(1)由D生成E的化学方程式为Br-CH2-COOH+2NaOH$→_{△}^{水}$HO-CH2-COONa+NaBr+H2O.
(2)上述合成线路中,涉及到的加成反应共有2步.
(3)苹果酸消去一分子水后的产物与乙二醇发生缩聚反应,生成的高分子化合物写出生成该高分子化合物反应的化学方程式为:n
 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O(4)写出与苹果酸具有相同种类和数目官能团的同分异构体结构简式:
 、
、 .
.
分析 Ⅰ氧的质量分数为59.7%,1mol该酸与足量的NaHCO3反应放出44.8L CO2,说明分子中含有2个-COOH,与足量的Na反应放出33.6L H2,为1.5mol,说明分子中含有3个-OH(包括-COOH)则至少含有5个O原子,如含有5个O,则相对原子质量为$\frac{5×16}{0.597}$=134,其相对分子质量大于112小于160,符合题意,核磁共振氢谱显示苹果酸中存在5种不同环境的H原子,则结构应为
Ⅱ75%(体积分数)的A水溶液常用于医疗消毒,A为CH3CH2OH,A连续发生氧化反应生成C,则B为CH3CHO,C为CH3COOH,由反应信息①可知,羧基连接的碳原子上的氢原子被溴原子取代,故D为Br-CH2-COOH,D发生水解反应生成E为HO-CH2-COONa,E酸化得到F为HO-CH2-COOH,F发生氧化反应得到G为HOOC-CHO,G与乙醛发生信息②中醛的加成反应生成H为 ,H酸化得到I为
,H酸化得到I为 ,I发生氧化反应得到J为
,I发生氧化反应得到J为 ,J与氢气发生加成反应得到苹果酸,以此解答该题.
,J与氢气发生加成反应得到苹果酸,以此解答该题.
解答 解:Ⅰ氧的质量分数为59.7%,1mol该酸与足量的NaHCO3反应放出44.8L CO2,说明分子中含有2个-COOH,与足量的Na反应放出33.6L H2,为1.5mol,说明分子中含有3个-OH(包括-COOH)则至少含有5个O原子,如含有5个O,则相对原子质量为$\frac{5×16}{0.597}$=134,其相对分子质量大于112小于160,符合题意,核磁共振氢谱显示苹果酸中存在5种不同环境的H原子,则结构应为
[1]根据上面的分析可知,苹果酸中的氧原子个数为5,苹果酸结构为
故答案为:5;C4H6O5;
[2](1)根据上面的分析可知,一个苹果酸分子中有1个-OH,
故答案为:1;
(2)根据上面的分析可知,苹果酸的结构简式为
故答案为:
Ⅱ75%(体积分数)的A水溶液常用于医疗消毒,A为CH3CH2OH,A连续发生氧化反应生成C,则B为CH3CHO,C为CH3COOH,由反应信息①可知,羧基连接的碳原子上的氢原子被溴原子取代,故D为Br-CH2-COOH,D发生水解反应生成E为HO-CH2-COONa,E酸化得到F为HO-CH2-COOH,F发生氧化反应得到G为HOOC-CHO,G与乙醛发生信息②中醛的加成反应生成H为 ,H酸化得到I为
,H酸化得到I为 ,I发生氧化反应得到J为
,I发生氧化反应得到J为 ,J与氢气发生加成反应得到苹果酸,
,J与氢气发生加成反应得到苹果酸,
(1)D→E反应的化学方程式为:Br-CH2-COOH+2NaOH$→_{△}^{水}$HO-CH2-COONa+NaBr+H2O,
故答案为:Br-CH2-COOH+2NaOH$→_{△}^{水}$HO-CH2-COONa+NaBr+H2O;
(2)上述合成线路中,涉及到的加成反应的有EG的反应以及J生成苹果酸的反应,共2步,
故答案为:2;
(3)苹果酸消去一分子水后的产物为


故答案为:n

(4)与苹果酸含有相同种类和数目的官能团的同分异构体的结构简式为:

故答案为:

点评 本题考查有机物的推断,注意计算确定苹果酸的分子式,结合含有的官能团及H原子种类判断苹果酸的结构简式,也可以利用乙烯发生的系列反应进行推断,是对有机化学的综合可知,难度中等.

| A. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作消毒剂和净水剂 | |
| B. | 在食品袋中放入盛有硅胶、生石灰的透气小袋,可防止食物受潮 | |
| C. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物有关 | |
| D. | 食用植物油的重要成分是高级不饱和脂肪酸甘油酯,是天然高分子化合物 |
| A. |  如图一个超氧化钾小晶胞中含有4个KO2 | |
| B. | 和K+距离相同且最近的O2-构成的多面体是正六面体 | |
| C. | 和K+距离相同且最近的K+有8个 | |
| D. | 和K+距离相同且最近的O2-共有8个 |
| A. | 酸性:HClO4>HBrO4>HIO4 碱性:NaOH>KOH>RbOH | |
| B. | 原子半径:Na>O>F 离子半径:Na+>O2->F- | |
| C. | 稳定性:HF>H2O>H2S 还原性:HCl<H2S<PH3 | |
| D. | 还原性:Na>Mg>Al 氧化性:P>S>Cl2 |
| A. | 3 mol/L HCl | B. | 4 mol/L HNO3 | C. | 8 mol/L NaOH | D. | 18 mol/L H2SO4 |
 .
.