��Ŀ����
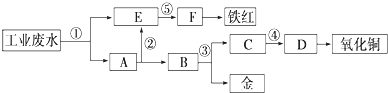
������Ԫ��A��B��C��D��E��ԭ����������������֪��
��C������������Ӧ��ˮ����������̬�⻯�ﷴӦ�������Σ�
��A�������������������Һ�壬A��Eͬ���壬C��B��D���ڣ�
��A��B��C��D����Ԫ�����һ�����ӻ�����F�������ԭ����֮��Ϊ5��1��1��3��
��ش��������⣺
��1��C����̬�⻯��ĵ���ʽΪ ��A�����ڱ��е�λ�� ��
��2��������E2D2�����������Ӹ�����Ϊ ��F���еĻ�ѧ������Ϊ ��
��3��F��Һ������EDA��ϡ��Һ��ϣ������ӷ���ʽΪ ��
��4��������C����̬�⻯�������а��̼�C2���ɣ�д���仯ѧ��Ӧ����ʽ ��
��5��C2A4����ȼ�ϵ����һ�ֻ����Ѻõļ���ȼ�ϵ�أ��������Һ��20%��30% KOH��Һ����ȼ�ϵ�صĸ�����ӦʽΪ ��
��6����CH4������������β���е����������Ⱦ��
��֪��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��l����H=-955kJ?mol-1
2NO2��g��=N2O4��g����H=-56.9kJ?mol-1
д��CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ ��
��C������������Ӧ��ˮ����������̬�⻯�ﷴӦ�������Σ�
��A�������������������Һ�壬A��Eͬ���壬C��B��D���ڣ�
��A��B��C��D����Ԫ�����һ�����ӻ�����F�������ԭ����֮��Ϊ5��1��1��3��
��ش��������⣺
��1��C����̬�⻯��ĵ���ʽΪ
��2��������E2D2�����������Ӹ�����Ϊ
��3��F��Һ������EDA��ϡ��Һ��ϣ������ӷ���ʽΪ
��4��������C����̬�⻯�������а��̼�C2���ɣ�д���仯ѧ��Ӧ����ʽ
��5��C2A4����ȼ�ϵ����һ�ֻ����Ѻõļ���ȼ�ϵ�أ��������Һ��20%��30% KOH��Һ����ȼ�ϵ�صĸ�����ӦʽΪ
��6����CH4������������β���е����������Ⱦ��
��֪��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��l����H=-955kJ?mol-1
2NO2��g��=N2O4��g����H=-56.9kJ?mol-1
д��CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ
���㣺λ�ýṹ���ʵ����ϵӦ��
ר�⣺
������������Ԫ��A��B��C��D��E��ԭ��������������C������������Ӧ��ˮ����������̬�⻯�ﷴӦ�������Σ���CΪ��Ԫ�أ�A�������������������Һ�壬��AΪ��Ԫ�أ�A��Eͬ���壬E��ԭ���������ڵ�Ԫ�أ���EΪNaԪ�أ�C��B��D���ڣ����ԭ��������֪��ӦΪͬ�������ڣ���BΪ̼Ԫ�ء�DΪ��Ԫ�أ�A��B��C��D����Ԫ�����һ�����ӻ�����F��1molF�к���10molԭ�ӣ���FΪNH4HCO3���ݴ˽��н��
���
�⣺�⣺������Ԫ��A��B��C��D��E��ԭ��������������C������������Ӧ��ˮ����������̬�⻯�ﷴӦ�������Σ���CΪ��Ԫ�أ�A�������������������Һ�壬��AΪ��Ԫ�أ�A��Eͬ���壬E��ԭ���������ڵ�Ԫ�أ���EΪNaԪ�أ�C��B��D���ڣ����ԭ��������֪��ӦΪͬ�������ڣ���BΪ̼Ԫ�ء�DΪ��Ԫ�أ�A��B��C��D����Ԫ�����һ�����ӻ�����F��1molF�к���10molԭ�ӣ���FΪNH4HCO3��
��1��C����̬�⻯��ΪNH3�������ʽΪ ��AΪ��Ԫ�أ����ڱ���λ���ǵ�һ���ڵڢ�A�壬
��AΪ��Ԫ�أ����ڱ���λ���ǵ�һ���ڵڢ�A�壬
�ʴ�Ϊ�� ����һ���ڵڢ�A�壻
����һ���ڵڢ�A�壻
��2��������E2D2ΪNa2O2��������������������ӹ��ɣ��������Ӹ�����Ϊ1��2��FΪNH4HCO3���������Ӽ������ۼ���
�ʴ�Ϊ��1��2�����Ӽ������ۼ���
��3��NH4HCO3��Һ������NaOH��ϡ��Һ��ϣ���Ӧ����̼������һˮ�ϰ�����Ӧ���ӷ���ʽΪ��2OH-+HCO3-+NH4+=CO32-+H2O+NH3?H2O��
�ʴ�Ϊ��2OH-+HCO3-+NH4+=CO32-+H2O+NH3?H2O��
��4��C����̬�⻯��ΪNH3��������NH3�����а��̼�N2���ɣ����ɵİ���ΪNH4Cl��8NH3+3Cl2=N2+NH4Cl��
�ʴ�Ϊ��8NH3+3Cl2=N2+NH4Cl��
��5��C2A4ΪN2H4��N2H4����ȼ�ϵ����һ�ֻ����Ѻõļ���ȼ�ϵ�أ���Ӧ����Ե�������Ⱦ�������жϷ�Ӧ���ɵ���������������¸���N2H4ʧȥ�������ɵ�����ˮ�������ĵ缫��ӦΪ��N2H4+4OH--4e-�T4H2O+N2����
�ʴ�Ϊ��N2H4+4OH--4e-�T4H2O+N2����
��6����CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��l����H=-955kJ?mol-1��
��2NO2��g��=N2O4��g����H=-56.9kJ?mol-1��
���ݸ�˹���ɣ���-�ڿɵ�CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ��CH4��g��+N2O4��g��=N2��g��+2H2O��l��+CO2��g����H=-898.1 kJ?mol-1��
�ʴ�Ϊ��CH4��g��+N2O4��g��=N2��g��+2H2O��l��+CO2��g����H=-898.1 kJ?mol-1��
��1��C����̬�⻯��ΪNH3�������ʽΪ
 ��AΪ��Ԫ�أ����ڱ���λ���ǵ�һ���ڵڢ�A�壬
��AΪ��Ԫ�أ����ڱ���λ���ǵ�һ���ڵڢ�A�壬�ʴ�Ϊ��
 ����һ���ڵڢ�A�壻
����һ���ڵڢ�A�壻��2��������E2D2ΪNa2O2��������������������ӹ��ɣ��������Ӹ�����Ϊ1��2��FΪNH4HCO3���������Ӽ������ۼ���
�ʴ�Ϊ��1��2�����Ӽ������ۼ���
��3��NH4HCO3��Һ������NaOH��ϡ��Һ��ϣ���Ӧ����̼������һˮ�ϰ�����Ӧ���ӷ���ʽΪ��2OH-+HCO3-+NH4+=CO32-+H2O+NH3?H2O��
�ʴ�Ϊ��2OH-+HCO3-+NH4+=CO32-+H2O+NH3?H2O��
��4��C����̬�⻯��ΪNH3��������NH3�����а��̼�N2���ɣ����ɵİ���ΪNH4Cl��8NH3+3Cl2=N2+NH4Cl��
�ʴ�Ϊ��8NH3+3Cl2=N2+NH4Cl��
��5��C2A4ΪN2H4��N2H4����ȼ�ϵ����һ�ֻ����Ѻõļ���ȼ�ϵ�أ���Ӧ����Ե�������Ⱦ�������жϷ�Ӧ���ɵ���������������¸���N2H4ʧȥ�������ɵ�����ˮ�������ĵ缫��ӦΪ��N2H4+4OH--4e-�T4H2O+N2����
�ʴ�Ϊ��N2H4+4OH--4e-�T4H2O+N2����
��6����CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��l����H=-955kJ?mol-1��
��2NO2��g��=N2O4��g����H=-56.9kJ?mol-1��
���ݸ�˹���ɣ���-�ڿɵ�CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ��CH4��g��+N2O4��g��=N2��g��+2H2O��l��+CO2��g����H=-898.1 kJ?mol-1��
�ʴ�Ϊ��CH4��g��+N2O4��g��=N2��g��+2H2O��l��+CO2��g����H=-898.1 kJ?mol-1��
���������⿼��λ�ýṹ���ʵ�Ӧ�ã���Ŀ�Ѷ��еȣ��漰���û�ѧ���Ԫ�ػ��������ʡ�������ԭ��Ӧ��ԭ��ء���˹�������Ȼ�ѧ����ʽ��д�е�Ӧ�õ�֪ʶ���ƶ�Ԫ���ǽ���Ĺؼ�����3����ע��Ϊ��������������ϡ��Һ��笠�������̼���������Ӧ�����ܵõ�������Ϊ�״��㣮

��ϰ��ϵ�д�
�����Ŀ
��7.4g Na2CO3?10H2O��NaHCO3��ɵĻ��������ˮ�����100mL��Һ������c��Na+��=0.6mol?L-1�����ѵ������Ļ������ȵ�����ʱ��������������ǣ�������
| A��3.18 g |
| B��2.21 g |
| C��5.28 g |
| D��4.22 g |
�������������У����ַ����в�������ͬ��������������ǣ�
| A��H2O2��CH3OH |
| B��H2O��CH4 |
| C��NHO2��HClO |
| D��H2S��F2 |
����ͭ��һ������Ũ���ᷴӦ���õ�����ͭ��Һ��NO2��NO�Ļ������2.24L����״��������Щ������һ�����O2����״������Ϻ�ͨ��ˮ�У�����������ȫ��ˮ�����������ᣮ������������ͭ��Һ�м���4mol?L-1NaOH��Һ��Cu2+ǡ����ȫ������������NaOH��Һ�������50mL������˵����ȷ���ǣ�������
| A���μӷ�Ӧ��������0.4mol |
| B���������������Ϊ1.68 L |
| C���˷�Ӧ������ת�Ƶĵ���Ϊ0.3 mol |
| D����������к�NO21.12 L |
����ҩƷ��ʹ�ú���������˵������ȷ���ǣ�������
| A����ù�صȿ����ضԲ�ԭ�������ƺ�ɱ�����ã�����ʹ��֮ǰҪ���й�����ʵ�� |
| B����ȡ����������Ȼ��������ֹʹ�������ã�����������к��������������ڶ�Ʒ |
| C����Ƽ��ǹ��ʰ�ί���ϸ��ֹʹ�õ��˷ܼ� |
| D��R��ʾ�Ǵ���ҩ��OTC��ʾ����ҩ |
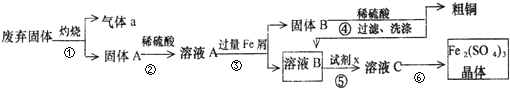
 298Kʱ��ij�ݻ��̶�Ϊ1L���ܱ������м���0.5mol A�������¿��淴Ӧ��A��g���T2B��g����H=a kJ?mol-1������B�����ʵ���Ũ����ʱ��仯��ͼ��
298Kʱ��ij�ݻ��̶�Ϊ1L���ܱ������м���0.5mol A�������¿��淴Ӧ��A��g���T2B��g����H=a kJ?mol-1������B�����ʵ���Ũ����ʱ��仯��ͼ��