题目内容
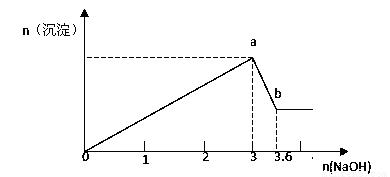
10.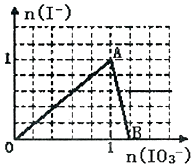 在含3molNaHSO3的溶液中加入含a mol NaIO3的溶液充分反应(不考虑I2+I-?I3-),所得溶液中的I-与加入NaIO3的物质的量的关系曲线如图所示,下列说法不正确的是( )
在含3molNaHSO3的溶液中加入含a mol NaIO3的溶液充分反应(不考虑I2+I-?I3-),所得溶液中的I-与加入NaIO3的物质的量的关系曲线如图所示,下列说法不正确的是( )| A. | 还原性HSO3->I-,氧化性:IO3->SO42->I2 | |
| B. | 当a=1时,溶液中n(I2):n(I-)=3:5 | |
| C. | AB段,反应的离子方程式为:IO3-+5I-+6H+═3I2+3H2O | |
| D. | l<a<1.2时,溶液中SO42-与I-的物质的量之比为3:(6-5a) |
分析 首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入NaIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,根据发生的反应来判断各个点的产物,由此分析解答.
解答 解:A、根据氧化还原反应中强制弱的原理,在反应:IO3-+3HSO3-═I-+3SO42-+3H+中,还原性HSO3->I-,氧化性:IO3->SO42-,而碘水与二氧化硫反应生成氢碘酸和硫酸,可知氧化性:SO42-<I2,故A错误;
B、当a=1时,溶液中n(I2):n(I-)=3:5,由反应IO3-+3HSO3-═I-+3SO42-+3H+可知,反应生成1mol的碘离子,则生成$\frac{3}{5}×1$mol的碘单质,所以溶液中n(I2):n(I-)=3:5,故B正确;
C、AB段,生成的碘离子被碘酸根离子氧化,反应的离子方程式为:IO3-+5I-+6H+═3I2+3H2O,故C正确;
D、l<a<1.2时,溶液中SO42-的物质的量为3mol,而生成I-的物质的量为:1mol,余IO3-的物质的量为:(a-1)mol,则0<a-1<0.2时,由反应IO3-+6H++5I-═3H2O+3I2,碘离子过量,所以反应的碘离子的物质的量为:5(a-1)mol,此时溶液中碘离子的物质的量为:(6-5a)mol,则SO42-与I-的物质的量之比为3:(6-5a),故D正确;
故选A.
点评 本题考查氧化还原反应,为高频考点,明确氧化性、还原性强弱及发生反应的先后顺序是解本题关键,易错点是D,注意结合原子守恒计算,题目难度中等.

练习册系列答案
相关题目
19.某学生欲确定某盐的成分,将其配成溶液甲,鉴定流程如图所示:
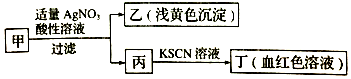
下列说法正确的是( )

下列说法正确的是( )
| A. | 如果甲中含有S2-,则乙是硫黄沉淀 | |
| B. | 丙中肯定含有Fe3+,所以甲是FeBr2溶液 | |
| C. | 甲中含有铁元素,可能显+2价或者+3价 | |
| D. | 若甲溶液滴加酸性KMnO4溶液,溶液变为黄色,则甲中一定含有Fe2+ |
17. 某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.
某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.
制备:在A中加入2~3片碎瓷片,8.0mL乙醇,4.0mL浓硫酸和5.7mL乙酸,连接好装置,在B中通入冷却水,用酒精灯缓慢加热A,回答下列问题:
(1)碎瓷片的作用是防止液体暴沸
(2)生成乙酸乙酯的化学方程式为CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.
(3)加入药品前必须有的操作是检查装置的气密性;冷凝管中水流的方向是b进a出;温度最好控制在77.2℃.
(4)产品提纯过程;C中液体$→_{振动静置}^{饱和碳酸钠溶液}$$\stackrel{操作1}{→}$有机层,操作I名称是分液.
(5)本实验中,为提高乙酸的转化率采取的措施有使用浓硫酸吸水、把酯蒸出反应体系、提高醇的用量比例等(能回答出两条措施即可)(至少两点).
 某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.
某学习小组用下列实验方案来制备乙酸乙酯,装置(夹持装置省略)如图.制备:在A中加入2~3片碎瓷片,8.0mL乙醇,4.0mL浓硫酸和5.7mL乙酸,连接好装置,在B中通入冷却水,用酒精灯缓慢加热A,回答下列问题:
(1)碎瓷片的作用是防止液体暴沸
(2)生成乙酸乙酯的化学方程式为CH3CH2OH+CH3COOH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.(3)加入药品前必须有的操作是检查装置的气密性;冷凝管中水流的方向是b进a出;温度最好控制在77.2℃.
(4)产品提纯过程;C中液体$→_{振动静置}^{饱和碳酸钠溶液}$$\stackrel{操作1}{→}$有机层,操作I名称是分液.
(5)本实验中,为提高乙酸的转化率采取的措施有使用浓硫酸吸水、把酯蒸出反应体系、提高醇的用量比例等(能回答出两条措施即可)(至少两点).
| 密度/(g•cm-3) | 沸点/℃ | |
| 乙酸 | 1.05 | 118.1 |
| 乙醇 | 0.780 | 78.3 |
| 乙酸乙酯 | 0.905 | 77.2 |
5.下列仪器名称正确的是( )
| A. |  三脚架 | B. |  溶量瓶 | C. |  镊子 | D. |  坩锅 |
15.短周期主族元素M、R、X、Y的原子序数依次增大,其中只有X属于金属元素,有M、R、X可组成一种化合物Q,298K时,0.1mol•L-1Q溶液是AG(酸度)=㏒$\frac{c({H}^{+})}{c(O{H}^{-})}$=-12,由M和Y组成的化合物MY是强电解质.下列说法正确的是( )
| A. | 简单离子半径:Y>R>X | |
| B. | Y的氧化物对应的水化物一定是强酸 | |
| C. | X分别与M、R、Y组成的二元化合物中都只含离子键 | |
| D. | 化合物XRM和XYR均能抑制水的电离 |
2.X、Y、Z、W、R 为原子序数依次增大的五种短周期主族元素. X原子的最外层电子数是其内层电子数的2倍,W+与Y2- 具有相同的电子层结构,R 与 Y 可形成RY2、RY3化合物.下列说法正确的是( )
| A. | Y 与氢元素所形成的化合物分子只含有极性键 | |
| B. | W2Y、W2Y2 中阴、阳离子个数比均为 1:2 | |
| C. | Z 的最高价氧化物对应水化物的酸性比 R 的强 | |
| D. | 将XY2通入 W 单质与水反应后的溶液中,生成的盐只有一种 |
19.下列有关糖类说法,错误的是 ( )
| A. | 葡萄糖和果糖分子式均为C6H12O6,均属于还原糖 | |
| B. | 淀粉和纤维素都属于多糖,其中每个葡萄糖单元包含三个羟基 | |
| C. | 糖类并不是都有甜味,有甜味的物质也不一定是糖类 | |
| D. | 葡萄糖具有多羟基醛的结构,属于最简单的单糖 |
 .
.