题目内容
4.下列说法正确的是( )| A. | 能使澄清石灰水变浑浊的气体一定是二氧化碳 | |
| B. | 氨气能使湿润的红色石蕊试纸变蓝 | |
| C. | 地壳中含量最多的元素是硅 | |
| D. | 二氧化碳是一种有色气体 |
分析 A.二氧化硫也可以和澄清石灰水反应生成亚硫酸钙白色沉淀;
B.氨气溶于水生成一水和氨显碱性;
C.地壳中元素含量多少分析,最多的是氧元素;
D.二氧化碳是无色气体.
解答 解:A.能使澄清石灰水变浑浊的气体不一定是二氧化碳,二氧化硫也可以和澄清石灰水反应生成亚硫酸钙白色沉淀,故A错误;
B.氨气溶于水显碱性能使湿润的红色石蕊试纸变蓝,故B正确;
C.地壳中含量最多的元素是氧元素,硅元素为第二位,故C错误;
D.二氧化碳是无色无味的气体,故D错误;
故选B.
点评 本题考查了物质性质、物质应用,主要是特征性质的方向,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
9.用NA表示阿佛加德罗常数的值,下列各项说法中正确的是( )
| A. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| B. | 一定条件下用含1mol FeCl3的溶液制备Fe(OH)3胶体,产生NA个Fe(OH)3胶粒 | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
10.下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O?H3O++Cl-
②Na2CO3+H2O?H2CO3+2NaOH
③Na2CO3+2H2O?H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+.
①HCl+H2O?H3O++Cl-
②Na2CO3+H2O?H2CO3+2NaOH
③Na2CO3+2H2O?H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O?NH3•D2O+H+.
| A. | ①②③④ | B. | ①②③ | C. | ②③⑤ | D. | 全部 |
7.下列离子组在指定溶液中能大量共存的是( )
| A. | 在含有大量HCO3-的溶液中:K+、Na+、Al3+、Br- | |
| B. | 使pH试纸变蓝的溶液中:NH4+、Na+、Cl-、ClO- | |
| C. | 含有0.1 mol•L-1Br-离子的溶液中:Cl-、Fe3+、Al3+、Cu2+ | |
| D. | 能使甲基橙变红的溶液中:Na+、K+、SO42-、AlO2- |
14.下列说法错误的是( )
| A. | PH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液c(Na + ):①>②>③ | |
| B. | 加热0.1mol/LNa2CO3溶液,CO3 2- 的水解程度和溶液的PH均增大 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红,原因是:CO3 2-+H2O?HCO3-+OH- |
9.用下列实验装置进行相应实验,能达到实验目的是( )
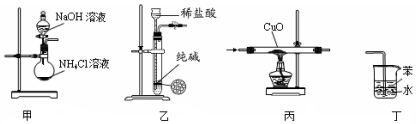

| A. | 用装置甲制取氨气 | B. | 用装置乙制取少量纯净的CO2气体 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收尾气氨气 |
16.下列叙述正确的是( )
| A. | Na2O与Na2O2都能与水反应生成碱,它们都是碱性氧化物 | |
| B. | Na2O2与水反应,Na2O2是氧化剂,水是还原剂 | |
| C. | 钠在常温下氧化生成Na2O2 | |
| D. | Na2O2可供氧剂,而Na2O不行 |
13.元素的原子结构决定其性质和元素周期表中的位置,下列说法正确的是( )
| A. | 元素原子的最外层电子数等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | S、Cl的电负性和单质的氧化性均依次增强 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
14.将过量的CO2分别通入①CaC12溶液;②Na2SiO3溶液;③Ca(C1O)2溶液;④饱和Na2CO3溶液.最终溶液中有白色沉淀析出的是( )
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ②③ |