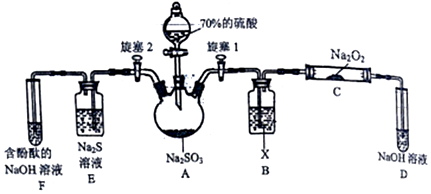
题目内容
17.某可逆反应:2A(g)?B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如表:实验 序号 | 时间/min 浓度/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
v(正)=(填“<”“>”或“=”)v(逆).
(2)0〜20min内,实验2比实验1的反应速率快(填“快”或“慢”),其原因可能是实验2中使用了催化剂.
(3)实验3比实验1的反应速率快(填“快”或“慢”),其原因是实验3中温度更高.
分析 (1)根据平均化学反应速率公式计算;50min与40min时A的浓度相等,说明已经达到平衡状态;
(2)实验1、2起始量相同,平衡浓度相同,但实验2达到平衡所需要的时间短,反应速率快;
(3)依据实验1、3比较实验数据可知,实验3温度高反应速率快,A转化率增大.
解答 解:(1)实验1中,在10〜20min内,以物质A表示的平均反应速率为:v(A)=$\frac{△c}{△t}$=$\frac{(0.8-0.67)mol/L}{10min}$=0.013mol/(L•min);
根据表中数据可知,40min以后A的浓度不再变化,说明40min后达到平衡状态,则50min时,v(正)=v(逆),
故答案为 0.013;=;
(2)实验1、2起始量相同,温度相同,平衡浓度相同,但实验2达到平衡所需要的时间短,反应速率快,说明加入了催化剂,加快反应速率,平衡不变,
故答案为:快;实验2中使用了催化剂;
(3)实验1、3起始量相同,但实验3达到平衡所需要的时间短,反应速率增大,根据图表可知,实验3温度比实验1高,
故答案为:快;实验3的温度更高.
点评 本题考查化学平衡的简单计算,题目难度不大,明确化学反应速率概念、化学平衡及其影响为解答关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
7.能直接构成物质的微粒有 ①分子 ②原子 ③质子 ④中子 ⑤电子 ⑥离子( )
| A. | ①③④ | B. | ①②⑥ | C. | ①④⑤ | D. | ②③④ |
8.高二(3)班某小组同学做完铜、锌-稀硫酸实验后,在读书卡片上记录如下:

卡片上的描述合理的是( )

卡片上的描述合理的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ①⑤⑥ | D. | ②③④ |
12.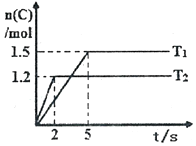 现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
 现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )| A. | T1<T2 | |
| B. | 该反应在温度为T1时达到平衡时,容器中A与C的物质的量浓度相等 | |
| C. | 温度为T2时,2s内B的平均速率为0.3mol•L-1•s-l | |
| D. | 温度为T1时,达平衡时反应物A的转化率为60% |
9.下列叙述中正确的是( )
| A. | 若反应2A(s)+B(g)?2C(g)△H>0 能自发进行,原因是△S<0 | |
| B. | 催化剂能改变反应的途径,但不能改变反应的△H | |
| C. | S(g)+O2(g)═SO2(g)△H1<0 S(s)+O2(g)═SO2(g)△H2<0 则△H1>△H2 | |
| D. | 化学平衡CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),增加H2O的浓度H2O的转化率增大 |
6.下列解释事实的方程式中不正确的是( )
| A. | 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2═2Na2O | |
| B. | 硫酸铵溶液与氢氧化钡溶液混合,产生气体:NH4++OH-═NH3↑+H2O | |
| C. | 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-═Ag2S+2I- |
 ,该结构二氯代物有3种(不考虑立体异构).
,该结构二氯代物有3种(不考虑立体异构).