题目内容
4.已知:有机物A是一种医药中间体,其相对分子质量为130.已知0.5molA完全燃烧只生成3molCO2和2.5molH2O.A可发生如图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成含甲基的六元环状酯类化合物.(已知:在酸性高锰酸钾溶液中,烯烃被氧化,碳碳双键完全断裂,CH2=基被氧化成CO2,RCH=基被氧化成羧酸,R(R1)C=基被氧化成酮.)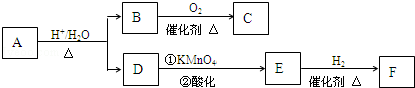
请回答:
(1)1molB与足量的金属钠反应产生的22.4L(标准状况)H2.B中所含官能团的名称是羟基.
B与C的相对分子质量之差为4,C的中文名称是乙二醛.
C参加并有金属单质生成的化学方程式是OHC-CHO+4Ag(NH3)2OH$→_{△}^{催化剂}$ 4Ag+H4NOOCCOONH4+6NH3+2H2O.
(2)D的同分异构体G所含官能团与D相同,则G的结构简式可能是CH2=CHCH2COOH、CH3CH=CHCOOH.
(3)F可发生多种类型的反应:
①两分子F反应生成的六元环状酯类化合物的结构简式是
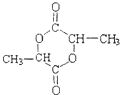 .
.②由F可生成使 Br2的CCl4溶液褪色的有机物H.
F→H的化学方程式是
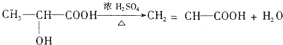 .
.③F在一定条件下发生缩聚反应的产物的结构简式是
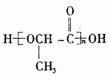 .
.(4)A的结构简式是CH2=C(CH3)COOCH2CH2OH.
分析 由0.5molA完全燃烧只生成3molCO2和2.5molH2O,则A分子中N(C)=$\frac{3mol}{0.5mol}$=6、N(H)=$\frac{2.5mol×2}{0.5mol}$=10,则N(O)=$\frac{130-12×6-10}{16}$=3,故A的分子式为C6H10O3,A水解得到B、D,则A含有酯基,因D的分子式为C4H6O2,则B的分子式为C2H6O2,B能发生催化氧化生成C,则B中含有羟基,由1molB与钠反应生成标况下22.4L氢气,则B为二元醇,即B为HOCH2CH2OH,B催化氧化为C,B与C的相对分子质量之差为4,则C的结构简式为:OHC-CHO.D为羧酸,不饱和度为2,能被酸性高锰酸钾氧化,故D分子中还含有1个碳碳双键,D氧化生成E,E能与氢气发生加成反应生成F,则F中含有羟基,由两分子F反应可生成含甲基的六元环状酯类化合物,则F中-COOH与-OH连接在同一碳原子上,可知F的结构简式为:CH3CH(OH)COOH,E的结构简式为:CH3COCOOH,D的结构简式为CH2=C(CH3)COOH,由B和D的结构简式,可知A的结构简式为:CH2=C(CH3)COOCH2CH2OH,据此解答.
解答 解:由0.5molA完全燃烧只生成3molCO2和2.5molH2O,则A分子中N(C)=$\frac{3mol}{0.5mol}$=6、N(H)=$\frac{2.5mol×2}{0.5mol}$=10,则N(O)=$\frac{130-12×6-10}{16}$=3,故A的分子式为C6H10O3,A水解得到B、D,则A含有酯基,因D的分子式为C4H6O2,则B的分子式为C2H6O2,B能发生催化氧化生成C,则B中含有羟基,由1molB与钠反应生成标况下22.4L氢气,则B为二元醇,即B为HOCH2CH2OH,B催化氧化为C,B与C的相对分子质量之差为4,则C的结构简式为:OHC-CHO.D为羧酸,不饱和度为2,能被酸性高锰酸钾氧化,故D分子中还含有1个碳碳双键,D氧化生成E,E能与氢气发生加成反应生成F,则F中含有羟基,由两分子F反应可生成含甲基的六元环状酯类化合物,则F中-COOH与-OH连接在同一碳原子上,可知F的结构简式为:CH3CH(OH)COOH,E的结构简式为:CH3COCOOH,D的结构简式为CH2=C(CH3)COOH,由B和D的结构简式,可知A的结构简式为:CH2=C(CH3)COOCH2CH2OH.
(1)B为乙二醇,含官能团为羟基,C的结构简式为:OHC-CHO,名称为乙二醛,C参加并有金属单质生成的化学方程式是:OHC-CHO+4Ag(NH3)2OH$→_{△}^{催化剂}$ 4Ag+H4NOOCCOONH4+6NH3+2H2O,
故答案为:羟基;乙二醛;OHC-CHO+4Ag(NH3)2OH$→_{△}^{催化剂}$ 4Ag+H4NOOCCOONH4+6NH3+2H2O;
(2)D的结构简式为:CH2=C(CH3)COOH,含官能团碳碳双键和羧基,与D具有相同官能团的同分异构体G为:CH2=CHCH2COOH、CH3CH=CHCOOH,
故答案为:CH2=CHCH2COOH、CH3CH=CHCOOH;
(3)①两分子F形成六元环酯,六元环状酯类化合物的结构简式是: ,故答案为:
,故答案为: ;
;
②由F可生成使 Br2的CCl4溶液褪色的有机物H,可知F发生了消去反应,反应方程式为: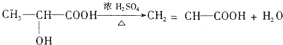 ,
,
故答案为: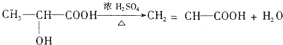 ;
;
③F含羟基和羧基,可发生缩聚反应生成聚酯,反应方程式为: ,缩聚反应的产物的结构简式是
,缩聚反应的产物的结构简式是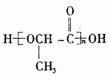 ,
,
故答案为: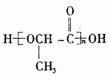 ;
;
(5)由上述分析可知,A的结构简式为:CH2=C(CH3)COOCH2CH2OH,故答案为:CH2=C(CH3)COOCH2CH2OH.
点评 本题考查了有机物的推断,注意从分子式的不同和相对分子质量的变化和反应条件来推知可能发生的反应类型,进而推出物质的结构,较好的考查学生分析推理能力,难度中等.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
Ⅰ、通过分析,对白色产物成分的可能情况提出了如下几种假设:
假设1:白色产物为Na2O
假设2:白色产物为Na2CO3
假设3:白色产物为Na2O和Na2CO3混合物
Ⅱ、为验证假设3正确,该小组同学设计了如下实验,请你帮他们完成下表内容.
限选试剂:蒸馏水、2mol/L H2SO4、BaCl2溶液、澄清石灰水、酚酞试剂、稀盐酸等;实验仪器任选.
| 实验步骤 | 预期现象及结论 |
①若假设2正确,则金属钠在二氧化碳中燃烧的化学方程式为:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
②有同学认为如果CO2足量则不会生成黑色物质,且白色产物成分也可以确定.此时的化学方程式为:2Na+2CO2$\frac{\underline{\;点燃\;}}{\;}$Na2CO3+CO.
| A. | NaOH | B. | Na2O | C. | Na | D. | CaO |
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-→CH3COO-+NH4++3NH3+2Aɡ↓+H2O | |
| C. | 向沸水中滴加FeCl3溶液制备胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| D. | 将Cl2溶于水中:Cl2+H2O═Cl-+2H++ClO- |
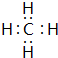 .
. 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知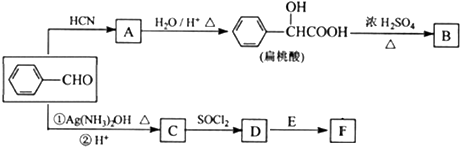

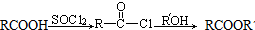 (R、Rˊ代表烃基)
(R、Rˊ代表烃基)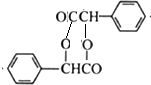 ,化合物C中的含氧官能团的名称是羧基.
,化合物C中的含氧官能团的名称是羧基. .
. .
.