题目内容
(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同.试运用盖斯定律回答下列问题:
已知:C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H1=-Q1 kJ?mol-1,
C2H5OH(g)═C2H5OH(l);△H2=-Q2 kJ?mol-1;
H2O(g)═H2O(l);△H3=-Q3 kJ?mol-1.
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 kJ.(用Q1、Q2、Q3表示)
(2)丙烷是一种优良的燃料,近年来已经研制出丙烷(C3H8)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式 .
已知:C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H1=-Q1 kJ?mol-1,
C2H5OH(g)═C2H5OH(l);△H2=-Q2 kJ?mol-1;
H2O(g)═H2O(l);△H3=-Q3 kJ?mol-1.
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
(2)丙烷是一种优良的燃料,近年来已经研制出丙烷(C3H8)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池
专题:化学反应中的能量变化,电化学专题
分析:(1)依据热化学方程式,结合盖斯定律计算得到热化学方程式;
(2)丙烷燃料电池,该电池的电解质溶液为H2SO4溶液,燃料在负极失电子发生氧化反应,氧气再正极得到电子发生还原反应,注意电解质溶液为酸溶液的环境.
(2)丙烷燃料电池,该电池的电解质溶液为H2SO4溶液,燃料在负极失电子发生氧化反应,氧气再正极得到电子发生还原反应,注意电解质溶液为酸溶液的环境.
解答:
解:(1)①C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H1=-Q1 kJ/mol,
②C2H5OH(g)=C2H5OH(l)△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l)△H3=-Q3 kJ/mol,
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q1-Q2+3Q3)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q1-0.5Q2+1.5Q3 )KJ,
故答案为:0.5Q1-0.5Q2+1.5Q3;
(2)丙烷燃料电池,该电池的电解质溶液为H2SO4溶液,燃料丙烷在负极失电子发生氧化反应,电极反应为:C3H8-20e-+6H2O=3CO2+20 H+,
故答案为:C3H8-20e-+6H2O=3CO2+20 H+.
②C2H5OH(g)=C2H5OH(l)△H2=-Q2 kJ/mol,
③H2O(g)=H2O(l)△H3=-Q3 kJ/mol,
依据盖斯定律:①-②+3×③得到:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H1=-(Q1-Q2+3Q3)kJ/mol,
若使23g液态无水酒精物质的量为0.5mol,完全燃烧,并恢复到室温,则整个过程中放出的热量为(0.5Q1-0.5Q2+1.5Q3 )KJ,
故答案为:0.5Q1-0.5Q2+1.5Q3;
(2)丙烷燃料电池,该电池的电解质溶液为H2SO4溶液,燃料丙烷在负极失电子发生氧化反应,电极反应为:C3H8-20e-+6H2O=3CO2+20 H+,
故答案为:C3H8-20e-+6H2O=3CO2+20 H+.
点评:本题考查了热化学方程式及其电极反应式知识,盖斯定律的运用,电极反应书写方法是解题关键,题目难度中等.

练习册系列答案
相关题目
已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,下列叙述正确的是( )
| A、向Ag2CrO4的浊液中加入AgNO3溶液,Ag2CrO4的Ksp减小 |
| B、将0.001 mol?L-1的AgNO3溶液逐滴加入到含Cl-和CrO42-浓度均为0.001 mol?L-1的溶液中,则先产生AgCl沉淀 |
| C、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| D、该温度下,AgCl在水中的溶解度小于在食盐水中的溶解度 |
已知Ksp(Ag2CrO4)=9.0×10-12,将等体积的4×10-3mol?L-1的AgNO3溶液和4×10-3mol?L-1的K2CrO4溶液混合,下列说法正确的是( )
| A、恰好形成Ag2CrO4饱和溶液 |
| B、能析出Ag2CrO4沉淀 |
| C、不能析出Ag2CrO4沉淀 |
| D、无法确定能否析出Ag2CrO4沉淀 |
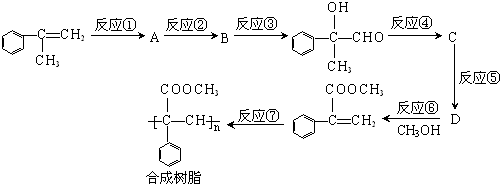
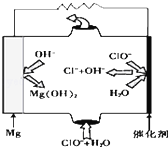 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写: