题目内容
7. t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 通过蒸发,可使溶液由a点变到c点 | |
| C. | 图中b点有AgBr沉淀析出 | |
| D. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K≈816 |
分析 A.由图中c点可知Ksp(AgBr);
B.由a点变到c点,溴离子浓度不变,而蒸发时溴离子浓度增大;
C.b点在曲线的上方,Qc>Ksp;
D.t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K=$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$.
解答 解:A.由图中c点可知Ksp(AgBr)=7×10-7×7×10-7=4.9×10-13,故A正确;
B.由a点变到c点,溴离子浓度不变,而蒸发时溴离子浓度增大,则不能通过蒸发实现由a点变到c点,故B错误;
C.b点在曲线的上方,Qc>Ksp,则b点有AgBr沉淀析出,故C正确;
D.t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K=$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$=$\frac{4×1{0}^{-10}}{4.9×1{0}^{-13}}$=≈816,故D正确;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp、K的计算、沉淀的生成为解答关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.

练习册系列答案
相关题目
14.某化学兴趣小组从香料中提取下列四种有机物成分,有关说法正确的是( )


| A. | ①②③④均可与Na、NaOH、H2发生反应,1mol四种物质最多消耗Na、NaOH、H2的物质的量之比依次分别为1:1:1:1、1:2:2:1、4:3:3:5 | |
| B. | ①②③④属同分异构体,分子式为C8H8O3 | |
| C. | 可用银氨溶液或酸性KMnO4溶液区分③④ | |
| D. | ①②③④中所有原子均不可能处于同一平面 |
15.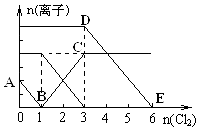 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+ 物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 |
15.锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2制备锰酸锂,生产流程如图1:
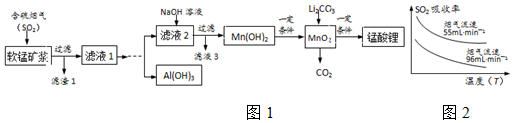
已知:
①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如表:
(1)已知:SO2的吸收率与温度及烟气流速的关系如图2.为提高含硫烟气中SO2的吸收率,可以采取的措施
降低通入含硫烟气的温度或减小通入含硫烟气的流速
(2)滤液1中所含金属阳离子有Mn2+、Al3+、Fe2+(填离子符号).
(3)在实际生产中,在实际生产中,Li2CO3与MnO2按物质的量之比为1:4混合均匀加热制取LiMn2O4.
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是MnO2对Li2CO3的分解有催化剂的作用
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B.请写出此过程发生的化学反应方程式4MnO2 $\frac{\underline{\;566℃\;}}{\;}$2Mn2O3+O2↑
③升温到720℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂.请写出发生的化学反应方程式2Li2O+4Mn2O3+O2$\frac{\underline{\;720℃\;}}{\;}$4LiMn2O4
(4)请补充完整由“滤液1”得到“滤液2”和Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中滴加足量过氧化氢,搅拌加入氢氧化钠溶液至4.7≤PH<7.7,过滤得到滤液2和固体向所得固体中加入氢氧化钠溶液至PH≥12,搅拌过滤再向所得滤液中通入二氧化碳过滤洗涤,低温烘干得到氢氧化铝(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)

已知:
①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
降低通入含硫烟气的温度或减小通入含硫烟气的流速
(2)滤液1中所含金属阳离子有Mn2+、Al3+、Fe2+(填离子符号).
(3)在实际生产中,在实际生产中,Li2CO3与MnO2按物质的量之比为1:4混合均匀加热制取LiMn2O4.
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是MnO2对Li2CO3的分解有催化剂的作用
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B.请写出此过程发生的化学反应方程式4MnO2 $\frac{\underline{\;566℃\;}}{\;}$2Mn2O3+O2↑
③升温到720℃时,A、B反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂.请写出发生的化学反应方程式2Li2O+4Mn2O3+O2$\frac{\underline{\;720℃\;}}{\;}$4LiMn2O4
(4)请补充完整由“滤液1”得到“滤液2”和Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中滴加足量过氧化氢,搅拌加入氢氧化钠溶液至4.7≤PH<7.7,过滤得到滤液2和固体向所得固体中加入氢氧化钠溶液至PH≥12,搅拌过滤再向所得滤液中通入二氧化碳过滤洗涤,低温烘干得到氢氧化铝(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
2.下列离子方程式正确的是( )
| A. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O | |
| B. | Na2O2与H2O反应:2O22-+2H2O=4OH-+O2↑ | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
19.苯甲酸粗品中含有泥沙和杂质 A(随温度变化 A 的溶解度变化很小),可通过系列操 作完成苯甲酸的提纯.则下列叙述正确的是( )
| A. | 苯甲酸易溶于水,可做食品防腐剂 | |
| B. | 提纯苯甲酸的过程中需要用到的玻璃仪器:烧杯、玻璃棒、漏斗 | |
| C. | 粗品中苯甲酸溶解后,还需再加入少量蒸馏水,以减少产品的损失 | |
| D. | 为了获得更多的苯甲酸,此实验中结晶温度越低越好 |
16.除去下列括号内杂质的试剂或方法错误的是( )
| A. | K2CO3(NH4Cl):加热 | |
| B. | CO2(SO2):饱和碳酸钠溶液、浓硫酸,洗气 | |
| C. | KCl溶液(BaCl2):加入适量K2SO4溶液,过滤. | |
| D. | 蛋白质(葡萄糖):浓Na2SO4溶液,盐析、过滤、洗涤 |
 25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,
25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,

