题目内容
17.以乙烯为原料生产环氧乙烷,经典的方法是氯代乙醇法,包括以下两步反应:①CH2=CH2+CI2+H2O→CICH2CH2OH+HCI
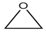
②

总的反应可表示为:

现代石油化式采用银作催化剂,可一步完成例:

经典的生产工艺的原子利用率是( )
| A. | 12.7% | B. | 25.4% | C. | 50.8% | D. | 76.2% |
分析 现代石油化式采用银作催化剂生成环氧乙烷,产物只有一种,原子利用率为100%,而经典的生产工艺中,产物有 、CaCl2、H2O,以此计算.
、CaCl2、H2O,以此计算.
解答 解:经典的生产工艺中,产物有 、CaCl2、H2O,原子利用率是$\frac{44}{44+111+18}$×100%=25.4%,
、CaCl2、H2O,原子利用率是$\frac{44}{44+111+18}$×100%=25.4%,
故选B.
点评 本题考查原子利用率的计算,为高频考点,把握目标产物及生成物为解答的关键,侧重分析与计算能力的考查,注意生成物只有一种时利用率为100%,题目难度不大.

练习册系列答案
相关题目
7. t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
 t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 通过蒸发,可使溶液由a点变到c点 | |
| C. | 图中b点有AgBr沉淀析出 | |
| D. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K≈816 |
8.3A(g)+2B(g)?2C(g)+3D(g).在温度和体积都相同的条件下分别建立两个平衡:①.A、B的起始物质的量为3mol和2mol,②.C、D的起始物质的量分别为4mol和6mol.四个选项中错误的是( )
| A. | 达平衡时,①途径的反应速率vA不等于②途径的反应速率vA | |
| B. | ①、②都达到平衡时,体系内混合气体的平均相对摩尔质量相同 | |
| C. | ①、②都达到平衡时,体系内混合气体的组成百分比相同 | |
| D. | 达平衡时,①途径所得混合气的密度为②途径所得混合气密度相同 |
2.检验氨气可选用( )
| A. | 湿润的蓝色石蕊试纸 | B. | 干燥的红色石蕊试纸 | ||
| C. | 干燥的蓝色石蕊试纸 | D. | 湿润的红色石蕊试纸 |
9.下列物质放置在空气中,不是因发生氧化还原反应而发生变质的是( )
| A. | Na2SO3 | B. | Na2O2 | C. | NaOH | D. | FeSO4 |
6.利用如图所示装置进行实验,下列说法不正确的是( )
| A. |  如图实验可制取少量氨气 | |
| B. |  如图实验中逐滴滴加稀盐酸时,试管中开始无气泡 | |
| C. |  如图实验中酸性KMnO4溶液中有大量气泡出现,酸性KMnO4溶液褪色 | |
| D. |  如图实验可观察到红色喷泉 |
12.X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
| A. | XYZ2 | B. | X2YZ3 | C. | X2Y2Z3 | D. | XYZ3 |
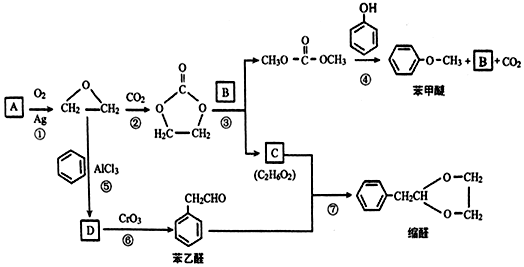
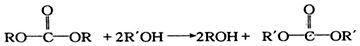
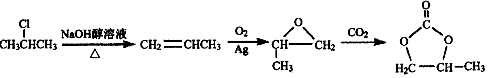
 .
.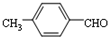 或
或
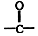 结构
结构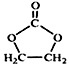 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备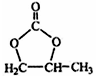 的合成流程图:
的合成流程图: