题目内容
将一定量的碳酸氢钠加热至没有气体放出时,测得剩余固体质量为10.6g
(1)计算原碳酸氢纳的物质的量
(2)将灼烧后的固体配成100mL溶液,计算溶液的物质的量浓度.
(1)计算原碳酸氢纳的物质的量
(2)将灼烧后的固体配成100mL溶液,计算溶液的物质的量浓度.
考点:化学方程式的有关计算
专题:计算题
分析:(1)加热NaHCO3至没有气体放出时,说明NaHCO3分解完全,剩余的物质根据NaHCO3受热分解的产物分析是;Na2CO3,先由n=
计算Na2CO3的物质的量,根据根据物质的量的变化比等于化学计量数之比得出碳酸氢钠的物质的量;
(2)依据(1)带入c=
计算碳酸钠的物质的量浓度.
| m |
| M |
(2)依据(1)带入c=
| n |
| V |
解答:
解:加热 NaHCO3至没有气体放出时,说明NaHCO3分解完全,2NaHCO3
Na2CO3 +CO2↑+H2O,因此剩余的物质为碳酸钠;n(Na2CO3)=
=0.1mol,n(NaHCO3)=0.1mol×2=0.2mol,
答:原碳酸氢钠的物质的量为0.2mol;
(2)碳酸氢钠的物质的量为0.1mol,100mL=0.1L,故c(Na2CO3)=
=1mol/L,
答:碳酸钠溶液的物质的量浓度为1mol/L.
| ||
| 10.6g |
| 106g/mol |
答:原碳酸氢钠的物质的量为0.2mol;
(2)碳酸氢钠的物质的量为0.1mol,100mL=0.1L,故c(Na2CO3)=
| 0.1mol |
| 0.1L |
答:碳酸钠溶液的物质的量浓度为1mol/L.
点评:本题考查了化学方应方程式的书写以及有关计算,题目难度不大,有利于培养学生的良好的分析能力和计算能力,提高学生学习的积极性.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
下列叙述正确的是( )
| A、SiO2、P2O5均能溶解在NaOH溶液中反应生成盐和水 |
| B、CuS,CaC2,Na2O2均能与稀硫酸反应产生气体 |
| C、F,Cl,Br,I的单质和氢化物的沸点随原子序数的增大而升高 |
| D、Li,Na,Mg,Al的最高价氧化物对应水化物的碱性逐渐减低 |
下列离子在有关溶液中能大量共存的是( )
| A、无色溶液:Al3+、K+、Cl-、S2- |
| B、滴加酚酞显红色的溶液:Na+、ClO-、NO3-、Cl- |
| C、滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- |
| D、c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
下列反应中,属于加成反应的是( )
| A、乙烯使溴水褪色 |
| B、乙烯使酸性高锰酸钾溶液褪色 |
| C、乙烯在空气中燃烧 |
| D、苯在浓硫酸条件下与浓硝酸共热 |
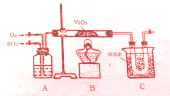 某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答:
某研究性学习小组为在实验室再现二氧化硫催化氧化的过程,应制取少量二氧化硫晶体,设计了如下图所示装置,已知三氧化硫通水生成硫酸并放出大量热,容易形成酸液,试回答: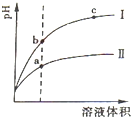 常温下有0.1mol?L-1四种溶液NaOH、NH3?H2O、HCl、CH3COOH
常温下有0.1mol?L-1四种溶液NaOH、NH3?H2O、HCl、CH3COOH