题目内容
X、Y、Z、W均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去):
X
Y
Z
(1)若W是单质铁,Z溶液是FeCl2溶液,则Y的水溶液与Cu反应的化学方程式为 .
(2)若W是氢氧化钠,Y溶液是NaHCO3溶液,则由X生成Z的离子反应方程式是 .
(3)若X是空气中含量最多的单质气体,Y是一种氧化物,则一充满标准状况下的Z气体的小试管倒置于水槽中,反应完全后,假设不考试试管内溶液的扩散.试管中所得液体的物质的量浓度为 mol/L.
X
| +W |
| +W |
(1)若W是单质铁,Z溶液是FeCl2溶液,则Y的水溶液与Cu反应的化学方程式为
(2)若W是氢氧化钠,Y溶液是NaHCO3溶液,则由X生成Z的离子反应方程式是
(3)若X是空气中含量最多的单质气体,Y是一种氧化物,则一充满标准状况下的Z气体的小试管倒置于水槽中,反应完全后,假设不考试试管内溶液的扩散.试管中所得液体的物质的量浓度为
考点:无机物的推断
专题:推断题
分析:(1)若W是单质铁,Z溶液是FeCl2溶液,则Y为FeC13,X应为Fe;
(2)若W是氢氧化钠,Y溶液是NaHCO3溶液,Z为Na2CO3,X为CO2;
(3)若X是空气中含量最多的单质气体,应为N2,Y是一种氧化物,则W为O2,Y为NO,Z为NO2.
(2)若W是氢氧化钠,Y溶液是NaHCO3溶液,Z为Na2CO3,X为CO2;
(3)若X是空气中含量最多的单质气体,应为N2,Y是一种氧化物,则W为O2,Y为NO,Z为NO2.
解答:
解:(1)若W是单质铁,Z溶液是FeCl2溶液,则Y为FeC13,X应为Fe,FeC13与Cu反应生成FeCl2和CuCl2,离子方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)若W是氢氧化钠,Y溶液是NaHCO3溶液,Z为Na2CO3,X为CO2,由X生成Z的离子反应方程式是CO2+2OH-=CO32-+H2O,故答案为:CO2+2OH-=CO32-+H2O;
(3)若X是空气中含量最多的单质气体,应为N2,Y是一种氧化物,则W为O2,Y为NO,Z为NO2,NO2和水发生:3NO2+H2O=2HNO3+NO,根据方程式知,水会充入烧瓶容积的
,溶液中的溶质是硝酸,其物质的量是二氧化氮的
,假设NO2为3mol,则生成2molHNO3,溶液体积为2mol×22.4L/mol=44.8L,
试管中所得液体的物质的量浓度为
=
mol/L,
故答案为:
.
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)若W是氢氧化钠,Y溶液是NaHCO3溶液,Z为Na2CO3,X为CO2,由X生成Z的离子反应方程式是CO2+2OH-=CO32-+H2O,故答案为:CO2+2OH-=CO32-+H2O;
(3)若X是空气中含量最多的单质气体,应为N2,Y是一种氧化物,则W为O2,Y为NO,Z为NO2,NO2和水发生:3NO2+H2O=2HNO3+NO,根据方程式知,水会充入烧瓶容积的
| 2 |
| 3 |
| 2 |
| 3 |
试管中所得液体的物质的量浓度为
| 2mol |
| 44.8L |
| 1 |
| 22.4 |
故答案为:
| 1 |
| 22.4 |
点评:本题考查无机物的推断,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握物质的性质,为解答该题的关键,难度不大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
下列溶液中溶质的物质的量浓度1mol/L的是( )
| A、将106gNa2CO3溶于100mL水中 |
| B、含3molO的硝酸溶于水得100mL溶液 |
| C、从2L物质的量浓度为1mol/L的NaCl溶液中取出100mL溶液 |
| D、22.4LHCl气体溶于水得1L溶液 |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,8gO2含有4NA个电子 |
| B、1L1mol/L的K2SO4中有NA个K+ |
| C、标准状况下,22.4L盐酸含有NA个HCl分子 |
| D、1molNa被完全氧化生成Na2O2,失去个NA电子 |
儿茶素(其结构简式如图所示)是茶叶的主要活性成分,具有抗氧化、抗菌、除臭等作用.下列说法正确的是( )
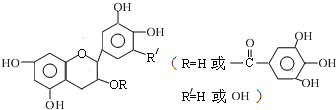

| A、常温下,儿茶素不溶于水,也不溶于有机溶剂 |
| B、儿茶素一定不能发生水解反应 |
| C、1mol儿茶素最少可与5mol NaOH反应 |
| D、儿茶素能与FeCl3溶液发生显色反应 |
下列物质的应用或转化与氧化还原反应原理有关的是( )
| A、工业上用铁矿石炼铁 |
| B、用稀盐酸除去钢铁表面的铁锈 |
| C、工业上煅烧石灰石制生石灰 |
| D、用胃舒平(氢氧化铝)治疗胃酸过多 |
等质量的下列烃:①甲烷 ②乙烷 ③乙烯 ④苯完全燃烧时,所消耗O2的量由少到多的顺序是( )
| A、①②③④ | B、④③②① |
| C、①③②④ | D、④②③① |


 利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺.在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g)?2NH3(g).保持恒温、恒容,测得反应达到平衡时有关数据如下:
利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺.在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g)?2NH3(g).保持恒温、恒容,测得反应达到平衡时有关数据如下: