题目内容
 下表为长式周期表的一部分,其中的序号代表对应的元素.
下表为长式周期表的一部分,其中的序号代表对应的元素.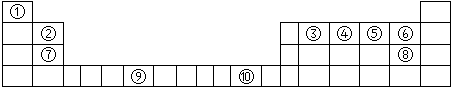
(1)元素④与⑥形成的气体化合物中,元素④的杂化方式为
(2)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:
反应过程中的离子方程式为
(3)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为
(4)元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,求该金属的密度为
考点:晶胞的计算,元素周期律和元素周期表的综合应用
专题:
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、Be、C、N、O、F、Mg、Cl、Cr、Cu元素,
(1)元素④与⑥形成的气体化合物为NF3中,根据价层电子对互斥理论确定原子杂化方式、分子空间构型;
(2)某元素的价电子排布式为nsnnpn+1,s能级最多排列2个电子,所以其价电子排布式为2s22p3,所以该元素是N元素,该元素可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有含⑩元素的硫酸盐硫酸铜溶液中,氨气先和水反应生成一水合氨,一水合氨和硫酸铜反应生成氢氧化铜蓝色沉淀,过量的一水合氨和氢氧化铜反应生成铜氨络合物;
(3)元素N的最高价氧化物对应的水化物稀溶液是稀硝酸,元素⑦的单质是Mg,元素④被还原到最低价,则生成氨气,二者反应生成硝酸镁、氨气和水;
(4)利用均摊法计算O原子个数;
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,则每个面上对角线长度为4dcm,其边长为2
dcm,体积为16
d3cm3,其密度ρ=
.
(1)元素④与⑥形成的气体化合物为NF3中,根据价层电子对互斥理论确定原子杂化方式、分子空间构型;
(2)某元素的价电子排布式为nsnnpn+1,s能级最多排列2个电子,所以其价电子排布式为2s22p3,所以该元素是N元素,该元素可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有含⑩元素的硫酸盐硫酸铜溶液中,氨气先和水反应生成一水合氨,一水合氨和硫酸铜反应生成氢氧化铜蓝色沉淀,过量的一水合氨和氢氧化铜反应生成铜氨络合物;
(3)元素N的最高价氧化物对应的水化物稀溶液是稀硝酸,元素⑦的单质是Mg,元素④被还原到最低价,则生成氨气,二者反应生成硝酸镁、氨气和水;
(4)利用均摊法计算O原子个数;
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,则每个面上对角线长度为4dcm,其边长为2
| 2 |
| 2 |
| m |
| V |
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、Be、C、N、O、F、Mg、Cl、Cr、Cu元素,
(1)元素④与⑥形成的气体化合物为NF3中,该分子中价层电子对个数=3+
×(5-3×1)=4且含有一个孤电子对,所以中心原子为sp3杂化,空间构型为三角锥形结构,故答案为:sp3;三角锥形;
(2)某元素的价电子排布式为nsnnpn+1,s能级最多排列2个电子,所以其价电子排布式为2s22p3,所以该元素是N元素,该元素可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有含⑩元素的硫酸盐硫酸铜溶液中,氨气先和水反应生成一水合氨,一水合氨和硫酸铜反应生成氢氧化铜蓝色沉淀,过量的一水合氨和氢氧化铜反应生成铜氨络合物,所以看到的现象是先出现蓝色沉淀后溶解,最后溶液呈深蓝色,离子方程式为Cu2++2OH-=Cu(OH)2↓、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:先出现蓝色沉淀后溶解,最后溶液呈深蓝色;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(3)元素N的最高价氧化物对应的水化物稀溶液是稀硝酸,元素⑦的单质是Mg,元素④被还原到最低价,则生成氨气,二者反应生成硝酸镁、氨气和水,反应方程式为4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,故答案为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O;
(4)该晶胞中Cu原子个数为4,O原子个数=1+8×
=2,则Cu、O原子个数之比=4:2=2:1,化学式为Cu2O,
故答案为:2;
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,则每个面上对角线长度为4dcm,其边长为2
dcm,体积为16
d3cm3,该晶胞中Cu原子个数=8×
+6×
=4,其密度ρ=
=
g?cm-3=
g?cm-3,
故答案为:
.
(1)元素④与⑥形成的气体化合物为NF3中,该分子中价层电子对个数=3+
| 1 |
| 2 |
(2)某元素的价电子排布式为nsnnpn+1,s能级最多排列2个电子,所以其价电子排布式为2s22p3,所以该元素是N元素,该元素可与元素①形成10电子的气体分子Y为NH3,将过量的NH3气体通入盛有含⑩元素的硫酸盐硫酸铜溶液中,氨气先和水反应生成一水合氨,一水合氨和硫酸铜反应生成氢氧化铜蓝色沉淀,过量的一水合氨和氢氧化铜反应生成铜氨络合物,所以看到的现象是先出现蓝色沉淀后溶解,最后溶液呈深蓝色,离子方程式为Cu2++2OH-=Cu(OH)2↓、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:先出现蓝色沉淀后溶解,最后溶液呈深蓝色;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(3)元素N的最高价氧化物对应的水化物稀溶液是稀硝酸,元素⑦的单质是Mg,元素④被还原到最低价,则生成氨气,二者反应生成硝酸镁、氨气和水,反应方程式为4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,故答案为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O;
(4)该晶胞中Cu原子个数为4,O原子个数=1+8×
| 1 |
| 8 |
故答案为:2;
(5)⑩元素单质晶体是面心立方体,立方体的每个面5个⑩原子紧密堆砌,⑩原子半径为d cm,则每个面上对角线长度为4dcm,其边长为2
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
16
|
| ||
| 8d3 |
故答案为:
| ||
| 8d3 |
点评:本题涉及晶胞计算、原子杂化、微粒空间构型判断、络合物等知识点,这些知识点都是高考高频点,会利用均摊法、价层电子对互斥理论分析解答,难点是晶胞计算,题目难度中等.

练习册系列答案
相关题目
下列各溶液中,c(Na+)最大的是( )
| A、0.8L 0.4mol/L的NaOH溶液 |
| B、0.2L0.15mol/L的Na3PO4 |
| C、1L0.3mol/L的NaCl溶液 |
| D、0.1L 0.5mol/L的NaCl溶液 |
NA为阿伏加德罗常数,下列叙述正确的是( )
| A、6.8g熔融的KHSO4中含有0.05NA个阴离子 |
| B、1.0L 1mol/L的NaOH水溶液中含有的氧原子数目为2 NA |
| C、25℃时,pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 |
| D、5.6g铁与一定量稀硝酸完全反应,电子转移数目一定为0.3NA |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、0.1mol?L-1CH3COONa溶液:H+、Al3+、Cl-、NO3- |
| B、含有NaNO3的溶液:H+、Fe2+、SO42-、Cl- |
| C、能使甲基橙变红的溶液:K+、Na+、NO3-、Cl- |
| D、由水电离产生的c(H+)=10-12 mol?L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
把各组中的气体通入溶液中,溶液导电能力显著增强的是( )
| A、NH3通入CH3COOH溶液中 |
| B、CO2通入澄清石灰水中 |
| C、CO2通入NaOH溶液中 |
| D、NH3通入盐酸中 |
下列各组中的两种物质在溶液中反应,可用同一离子方程式表示的是( )
| A、氨水分别与盐酸、醋酸反应 |
| B、硫酸铜分别与BaCl2、Ba(OH)2反应 |
| C、石灰石分别与盐酸、硝酸反应 |
| D、稀硫酸分别与Na2CO3、NaHCO3溶液反应 |
 碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某兴趣小组用0.50mol?L-1KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.