题目内容
0.44g由硫跟铁组成的混合物,在氧气中灼烧,使其中的硫全部转化为二氧化硫.再把二氧化硫全部氧化为三氧化硫,并转变为硫酸,恰好与20ml 0.5mol/L的氢氧化钠完全中和,则原来化合物中硫的质量分数为多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=cV计算NaOH的物质的量,关系式为S~SO2~H2SO4~2NaOH,据此计算S元素物质的量,再计算S元素质量,进而可计算质量分数.
解答:
解:n(NaOH)=0.02L×0.50mol/L=0.01mol,
由反应的关系式S~SO2~H2SO4~2NaOH可知,n(S)=0.01mol×
=0.005mol,
则硫和铁组成的化合物中m(S)=0.005mol×32g/mol=0.16g,
则ω(S)=
×100%=36%,
答:原来化合物中硫的质量分数为36%.
由反应的关系式S~SO2~H2SO4~2NaOH可知,n(S)=0.01mol×
| 1 |
| 2 |
则硫和铁组成的化合物中m(S)=0.005mol×32g/mol=0.16g,
则ω(S)=
| 0.16g |
| 0.44g |
答:原来化合物中硫的质量分数为36%.
点评:本题考查化学方程式有关计算,题目难度不大,对应多步反应的计算,注意关系式的进行解答.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
下列实验能达到目的是( )
| A、用AgNO3溶液可鉴别HCl溶液和NaCl溶液 | ||||
B、用BaCl2溶液鉴别SO
| ||||
| C、用浓HNO3与Cu反应制备NO2 | ||||
| D、将混合HCl的Cl2通入饱和NaHCO3溶液中 |
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述不正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述不正确的是( )| A、分子式为C23H38O7 |
| B、能使酸性KMnO4 溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1 mol 该物质最多可与2 mol NaOH 反应 |

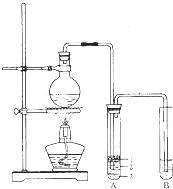 实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: