题目内容
(1)鉴别KCl溶液和K2CO3的试剂是 ,离子方程式为为 .
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 .
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 .
(4)明矾在水中的电离方程式是 ,明矾的用途 .
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是
(3)除去Na2CO3粉末中混入的NaHCO3杂质用
(4)明矾在水中的电离方程式是
考点:物质的检验和鉴别的基本方法选择及应用,离子方程式的书写,物质的分离、提纯和除杂
专题:离子反应专题,元素及其化合物
分析:(1)鉴别KCl溶液和K2CO3的试剂是HCl,碳酸钾和HCl反应生成气体;
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是HCl,碳酸氢钠和HCl反应生成氯化钠;
(3)采用加热的方法除去碳酸钠中的碳酸氢钠;
(4)明矾在水溶液中电离生成铝离子、钾离子和硫酸根离子,明矾可以净水.
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是HCl,碳酸氢钠和HCl反应生成氯化钠;
(3)采用加热的方法除去碳酸钠中的碳酸氢钠;
(4)明矾在水溶液中电离生成铝离子、钾离子和硫酸根离子,明矾可以净水.
解答:
解:(1)鉴别KCl溶液和K2CO3的试剂是盐酸,碳酸钾和HCl反应生成气体,离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:盐酸;CO32-+2H+=CO2↑+H2O;
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是盐酸,碳酸氢钠和HCl反应生成氯化钠,离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:盐酸;HCO3-+H+=CO2↑+H2O;
(3)碳酸氢钠不稳定,受热易分解生成碳酸钠,所以采用加热的方法除去碳酸钠中的碳酸氢钠,反应方程式为2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:加热;2NaHCO3
Na2CO3+CO2↑+H2O;
(4)明矾在水溶液中电离生成铝离子、钾离子和硫酸根离子,电离方程式为KAl(SO4)2=Al3++K++2SO42-,铝离子水解生成氢氧化铝胶体,胶体具有吸附性,所以明矾可以净水,故答案为:KAl(SO4)2=Al3++K++2SO42-;作净水剂.
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是盐酸,碳酸氢钠和HCl反应生成氯化钠,离子方程式为HCO3-+H+=CO2↑+H2O,故答案为:盐酸;HCO3-+H+=CO2↑+H2O;
(3)碳酸氢钠不稳定,受热易分解生成碳酸钠,所以采用加热的方法除去碳酸钠中的碳酸氢钠,反应方程式为2NaHCO3
| ||
| ||
(4)明矾在水溶液中电离生成铝离子、钾离子和硫酸根离子,电离方程式为KAl(SO4)2=Al3++K++2SO42-,铝离子水解生成氢氧化铝胶体,胶体具有吸附性,所以明矾可以净水,故答案为:KAl(SO4)2=Al3++K++2SO42-;作净水剂.
点评:本题以除杂、物质的用途为载体考查了物质的性质,难点是除杂剂的选取,根据物质和杂质之间的不同点结合物质的性质选取合适的除杂剂,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
大米中含有丰富的维生素B1、B2,应怎样淘米营养素损失少?( )
| A、用热水烫洗 |
| B、浸泡后再流水冲洗 |
| C、用力搓洗 |
| D、根据米的清洁程度适当清洗 |
对于常温下pH=2盐酸,叙述正确的是( )
| A、与pH=2的CH3COOH溶液中c(H+)相同 |
| B、与等体积pH=12的氨水混合后所得溶液pH=7 |
| C、与等体积pH=12的氢氧化钡溶液混合后所得溶液pH=7 |
| D、与等体积0.01mol?L-1 CH3COONa溶液混合后所得溶液中c(Cl-)=c(CH3C00-) |
下列有关化学用语表示正确的是( )
| A、乙酸的结构简式:C2H4O2 |
| B、中子数为20的氯原子:2017Cl |
C、S2-的结构示意图: |
D、NH3 的电子式: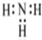 |
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
| A、利用蒸馏原理从海水中提取淡水是海水淡化技术发展的新方向 |
| B、因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| C、从海水中可得到NaCl,电解熔融NaCl或NaCl的水溶液都可制得Cl2 |
| D、无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能 |
