题目内容
8.X、Y、Z、W为原子序数依次增大的短周期主族元素,X元素的某种原子失去1个电子后变成1个质子,Y元素原子最外层电子数是其质子数的$\frac{5}{7}$,Z是地壳中含量最多的元素,Z和W为同主族.下列说法正确的是( )| A. | 简单氢化物的沸点:Y>Z | |
| B. | 阴离子的半径:Y<Z | |
| C. | Y和W的氧化物对应水化物均为强酸 | |
| D. | X、Y、Z、W四种元素可形成离子化合物 |
分析 X、Y、Z、W是原子序数依次增大的短周期主族元素,X元素的某种原子失去1个电子后变成1个质子,则X为H元素;Z是地壳中含量最多的元素,则Z为O元素,Z与W同主族,则W为S元素;结合原子序数可知Y处于第二周期,Y元素原子最外层电子数是其质子数的$\frac{5}{7}$,设最外层电子数为a,则(2+a)×$\frac{5}{7}$=a,解得a=5,故Y为N元素,据此解答.
解答 解:X、Y、Z、W是原子序数依次增大的短周期主族元素,X元素的某种原子失去1个电子后变成1个质子,则X为H元素;Z是地壳中含量最多的元素,则Z为O元素,Z与W同主族,则W为S元素;结合原子序数可知Y处于第二周期,Y元素原子最外层电子数是其质子数的$\frac{5}{7}$,设最外层电子数为a,则(2+a)×$\frac{5}{7}$=a,解得a=5,故Y为N元素.
A.常温下水为液态,而氨气为气体,故水的沸点高于氨气的,故A错误;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径Y(N3-)>Z(O2-),故B错误;
C.亚硫酸为弱酸、亚硝酸为弱酸,故C错误;
D.X、Y、Z、W四种元素可形成硫酸铵、硫酸氢铵等,硫酸铵、硫酸氢铵属于离子化合物,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,C选项为易错点,容易忽略最高价氧化物,注意对元素周期律的理解掌握,难度中等.

练习册系列答案
相关题目
19.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
| A. | 原子序数X>Y | B. | 最外层电子数X>Y | C. | 原子半径X<Y | D. | 最高正价X>Y |
16.25℃时,下列四种溶液中,由水电离生成的氢离子浓度之比①:②:③:④是( )
①1mol•L-1的盐酸 ②0.1mol•L-1的盐酸 ③0.01mol•L-1的NaOH溶液 ④1mol•L-1的NaOH溶液.
①1mol•L-1的盐酸 ②0.1mol•L-1的盐酸 ③0.01mol•L-1的NaOH溶液 ④1mol•L-1的NaOH溶液.
| A. | 1:10:100:1 | B. | 1:10-1:10-12:10-14 | ||
| C. | 14:13:12:14 | D. | 14:13:2:1 |
3.下列仪器:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④坩埚⑤分液漏斗⑥燃烧匙常用于物质分离的是( )
| A. | ①③④ | B. | ①②⑥ | C. | ①③⑤ | D. | ③⑤⑥ |
18.①乙酸乙酯 ②淀粉 ③蛋白质 ④油脂,在稀酸存在下分别进行水解,最终生成物只有一种的是( )
| A. | ①和② | B. | 只有② | C. | ②③和④ | D. | 只有④ |

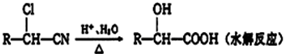
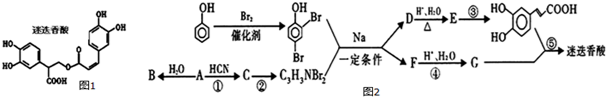
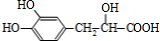 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$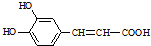 +H2O
+H2O .
.