题目内容
1.下列溶液中c(Cl-)与50mL 1mol•L-1AlCl3溶液中c(Cl-)相等的是( )| A. | 75 mL 1.5 mol•L-1的MgCl2溶液 | B. | 75 mL 4 mol•L-1的NH4Cl溶液 | ||
| C. | 150 mL 2 mol•L-1的KCl溶液 | D. | 150 mL 1 mol•L-1的NaCl溶液 |
分析 50mL1mol/L的AlCl3溶液中的Cl-浓度为3mol/L,根据溶质化学式计算各选项中的Cl-物质的量,进行比较可知.注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.据此分析.
解答 解:A、75 mL 1.5 mol•L-1的MgCl2溶液中氯离子浓度为1.5mol/L×2=3mol/L,故A正确;
B、75 mL 4 mol•L-1的NH4Cl溶液中氯离子浓度为4mol/L×1=4mol/L,故B错误;
C、150 mL 2 mol•L-1的KCl溶液中氯离子浓度为2mol/L×1=2mol/L,故C错误;
D、150 mL 1 mol•L-1的NaCl溶液中氯离子浓度为1mol/L×1=1mol/L,故D错误;
故选A.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
16.下列叙述中,正确的是( )
| A. | 钢铁腐蚀的负极反应为:Fe-3e-=Fe3+ | |
| B. | 碱性介质甲烷燃料电池的正极反应为:O2+2H2O+4e-═4OH- | |
| C. | Mg-Al及NaOH溶液构成的原电池中负极材料为Mg | |
| D. | 氯碱工业中阳极上产生的气体比阴极上产生的气体多 |
17.乙醇和乙酸是生活中两种常见的有机物.下列有关说法不正确的是( )
| A. | 乙醇和乙酸都能杀菌消毒 | B. | 乙醇和乙酸都是电解质 | ||
| C. | 乙醇和乙酸都能发生酯化反应 | D. | 乙醇和乙酸都能与活泼金属反应 |
14.下列离子方程式中书写正确的是( )
| A. | 将Na2O2固体加入水中:Na2O2+2H2O=2Na++2OH-+O2↑ | |
| B. | Ba(OH)2溶液与硫酸的反应:OH-+H+=H2O | |
| C. | Cl2溶于水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 少量CO2通入澄清石灰水中:CO2+2OH-+Ca2+═Ca CO3↓+2H2O |
6.下列各组物质的分类正确的是( )
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏;
③酸性氧化物:CO2、CO、SO3
④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨
⑥干冰、液氯都是非电解质.
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏;
③酸性氧化物:CO2、CO、SO3
④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨
⑥干冰、液氯都是非电解质.
| A. | ②⑤ | B. | ②⑤⑥ | C. | ②④⑤⑥ | D. | ①②③④⑤⑥ |
13.欧盟国家将从今年起禁用水银温度计,因为它在使用中易破碎,泄漏水银而危害人体健康,水银属于( )
| A. | 化合物 | B. | 混合物 | C. | 单质 | D. | 氧化物 |
10.对于反应N2O4(g)?2NO2(g)△H>0,要使该反应的平衡常数值增大,可以采取的措施有( )
| A. | 增大N2O4的浓度 | B. | 增大NO2的浓度 | C. | 升高体系的温度 | D. | 减小压强 |
11.在室温下取pH=a的NH3•H2O、NaOH溶液各1mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,下列说法不正确的是( )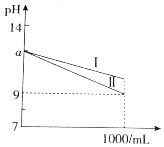

| A. | 曲线Ⅰ表示NaOH溶液中pH的变化 | |
| B. | 开始时两溶液中水的电离程度相同 | |
| C. | 由图象可知,开始时c(NaOH)=0.01mol•L-1 | |
| D. | 在稀释过程中氨水溶液中的$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |