题目内容
9.下列说法正确的是( )| A. | 金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属甲比金属乙活泼 | |
| B. | 原电池中电子从负极经过溶液流向正极 | |
| C. | 电解池中电解质溶液的阳离子向阴极迁移 | |
| D. | 在铁制品上镀银,铁做正极,银做负极 |
分析 A、金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属乙比金属甲活泼.
B、电子不能进入溶液.
C、电解质溶液的阳离子向阴极迁移.
D、电镀时,镀层作阳极,镀件作阴极.
解答 解:A、金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属乙比金属甲活泼,故A错误.
B、电子不能进入溶液,所以原电池中电子从负极经过外电路流向正极,故B错误.
C、电解池中电解质溶液的阳离子向阴极迁移,故C正确.
D、电镀时,镀层作阳极,镀件作阴极,所以在铁制品上镀银,铁做阴极,银做阳极,故D错误.
故选C.
点评 本题考查了电化学原理,难度不大,明确电镀和电解池、原电池的原理都是解题关键.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
20.结构简式 表示的有机物中,能发生消去反应的卤代烃共有( )
表示的有机物中,能发生消去反应的卤代烃共有( )
 表示的有机物中,能发生消去反应的卤代烃共有( )
表示的有机物中,能发生消去反应的卤代烃共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
14.已知反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,当转移6mol电子时,被还原的HNO3的物质的量为( )
| A. | 8mol | B. | 4mol | C. | 2mol | D. | 6mol |
2.下列装置或操作能达到实验目的是( )


| A. | 装置①依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 装置②依据反应后U管两边液面的高低,判断Na和水反应的热效应 | |
| C. | 装置③测定稀强酸与稀强碱反应的中和热 | |
| D. | 装置④用标准的盐酸溶液滴定待测的氢氧化钠溶液(部分加持仪器略去) |
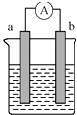 如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.
如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题. 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.