题目内容
19.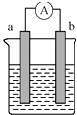 如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.
如图是某化学兴趣小组探究不同条件下化学能转化为电能的装置.请回答下列问题.(1)当电极a为Zn,电极b为Cu,电解质溶液为稀硫酸时,负极的电极反应式为:Zn-2e-═Zn2+.正极的电极反应式为:2H++2e-=H2↑
(2)外电路中的电子是从Zn电极流向Cu电极.
(3)当a极溶解的质量为6.5g时,有0.2mol电子通过导线.
分析 (1)Zn、Cu、稀硫酸构成的原电池,金属Zn作负极,金属Cu为正极,正极上氢离子得到电子,负极上Zn失去电子;
(2)外电路中的电子从负极移向正极;
(3)根据负极反应进行计算.
解答 解:(1)Zn、Cu、稀硫酸构成的原电池,金属Zn作负极,金属Cu为正极,正极上氢离子得到电子,反应为2H++2e-=H2↑,负极上Zn失去电子,反应为Zn-2e-═Zn2+,故答案为:Zn-2e-═Zn2+,2H++2e-=H2↑;
(2)外电路中的电子从负极移向正极,即从Zn电极流向Cu电极,故答案为:Zn;Cu;
(3)因为负极反应为Zn-2e-═Zn2+,所以当a极溶解的质量为6.5g时,有$\frac{6.5}{65}$×2=0.2mol电子通过导线,故答案为:0.2.
点评 本题考查原电池原理,为高频考点,把握图中装置的分析及原电池的工作原理为解答的关键,侧重电极、电极反应、转移电子的考查,题目难度不大.

练习册系列答案
相关题目
9.下列实验中,所选装置不合理的是( )


| A. | 分离花生油和NaCl溶液混合液,选④ | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 用NaOH溶液吸收CO中混有的CO2选⑤ | D. | 粗盐提纯,选①和② |
7.下列化学用语中正确的是( )
| A. | CH4分子的比例模型: | B. | 羟基的电子式: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙醇的分子式:CH3CH2OH |
14.下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)⑦是铝元素(填元素名称).
(2)请写出⑨的原子结构示意图: .
.
(3)④、⑤、⑧元素非金属性由强到弱的顺序是F>O>S(用元素符号表示).
(4)⑥与⑦两种元素金属性强弱顺序为:⑥>⑦(填“>”或“<”或“=”)
(5)请写出⑧元素最高价氧化物的化学式:SO3.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)请写出⑨的原子结构示意图:
 .
.(3)④、⑤、⑧元素非金属性由强到弱的顺序是F>O>S(用元素符号表示).
(4)⑥与⑦两种元素金属性强弱顺序为:⑥>⑦(填“>”或“<”或“=”)
(5)请写出⑧元素最高价氧化物的化学式:SO3.
4.关于维生素的叙述正确的是( )
| A. | 维生素是构成人体细胞和组织的重要材料 | |
| B. | 维生素能为人体提供能量 | |
| C. | 维生素调节新陈代谢、预防疾病和维持身体健康 | |
| D. | 维生素都溶于水 |
11.下列各种试纸,在使用时预先不能用蒸馏水润湿的是( )
| A. | 红色石蕊试纸 | B. | 碘化钾淀粉试纸 | C. | pH试纸 | D. | 蓝色石蕊试纸 |
8.下列有机物中,属于糖类的是( )
| A. | 油脂 | B. | 淀粉 | C. | 酒精 | D. | 蛋白质 |
9.下列说法正确的是( )
| A. | 金属甲的阳离子比同价态的金属乙的阳离子氧化性强,则金属甲比金属乙活泼 | |
| B. | 原电池中电子从负极经过溶液流向正极 | |
| C. | 电解池中电解质溶液的阳离子向阴极迁移 | |
| D. | 在铁制品上镀银,铁做正极,银做负极 |