题目内容
某无色透明溶液中可能含有下列离子:K+、H+、Ba2+、OH-、CO32-、Cl-、NO3-,且该溶液能与Al反应放出H2.取三支试卷,分别加入少量反应后的溶液进行如下实验:
①一支滴加一定量的KOH溶液,有白色沉淀生成;
②一支滴加稀硫酸,没有白色沉淀生成;
③一支滴加硝酸银溶液,有白色沉淀生成.
请回答:
(1)根据实验判断溶液中一定不存在的离子是 ;一定存在的离子是 ;可能存在的离子是 .
(2)实验①和③中生成白色沉淀的离子方程式为 .
①一支滴加一定量的KOH溶液,有白色沉淀生成;
②一支滴加稀硫酸,没有白色沉淀生成;
③一支滴加硝酸银溶液,有白色沉淀生成.
请回答:
(1)根据实验判断溶液中一定不存在的离子是
(2)实验①和③中生成白色沉淀的离子方程式为
考点:常见阴离子的检验,常见阳离子的检验
专题:
分析:(1)无色透明溶液能与Al反应放出H2,该溶液可能为强碱性溶液,也可能为酸性溶液;向反应后溶液滴加KOH溶液,有白色沉淀生成,说明反应后溶液中含有铝离子,则原溶液为酸性溶液,含有H+,则OH-、CO32-、NO3-不存在;
向反应后溶液滴加稀硫酸,没有白色沉淀生成,排除钡离子存在;
向反应后溶液滴加硝酸银溶液,有白色沉淀生成,该白色沉淀氯化银,说明溶液中含有氯离子,据此判断溶液中离子存在情况;
(2)①发生反应为:铝离子与氢氧根离子反应生成氢氧化铝沉淀;
③发生反应为:银离子与氯离子反应生成氯化银沉淀.
向反应后溶液滴加稀硫酸,没有白色沉淀生成,排除钡离子存在;
向反应后溶液滴加硝酸银溶液,有白色沉淀生成,该白色沉淀氯化银,说明溶液中含有氯离子,据此判断溶液中离子存在情况;
(2)①发生反应为:铝离子与氢氧根离子反应生成氢氧化铝沉淀;
③发生反应为:银离子与氯离子反应生成氯化银沉淀.
解答:
解:(1)无色透明溶液能与Al反应放出H2,该溶液可能为强碱性溶液,也可能为酸性溶液;
向反应后溶液滴加KOH溶液,有白色沉淀生成,说明反应后溶液中含有铝离子,则原溶液为酸性溶液,含有H+,OH-、CO32-与都能发生反应,不共存,所以OH-、CO32-一定不存在,硝酸与铝反应不会产生氢气,所以一定不含NO3-;
向反应后溶液滴加稀硫酸,没有白色沉淀生成,说明钡离子一定不存在;
向反应后溶液滴加硝酸银溶液,有白色沉淀生成,该白色沉淀氯化银,说明溶液中含有氯离子,
所以溶液中一定不存在的离子为:Ba2+、OH-、CO32-、NO3-;一定存在的是:H+、Cl-;可能存在的离子是:K+;
故答案为:Ba2+、OH-、CO32-、NO3-;H+、Cl-;K+;
(2)①中铝离子与氢氧根离子反应生成氢氧化铝沉淀,离子方程式为:Al3++3OH-=Al(OH)3↓;
②中银离子与氯离子反应生成氯化银沉淀,离子方程式为:Ag++Cl-=AgCl↓;
故答案为:Al3++3OH-=Al(OH)3↓、Ag++Cl-=AgCl↓.
向反应后溶液滴加KOH溶液,有白色沉淀生成,说明反应后溶液中含有铝离子,则原溶液为酸性溶液,含有H+,OH-、CO32-与都能发生反应,不共存,所以OH-、CO32-一定不存在,硝酸与铝反应不会产生氢气,所以一定不含NO3-;
向反应后溶液滴加稀硫酸,没有白色沉淀生成,说明钡离子一定不存在;
向反应后溶液滴加硝酸银溶液,有白色沉淀生成,该白色沉淀氯化银,说明溶液中含有氯离子,
所以溶液中一定不存在的离子为:Ba2+、OH-、CO32-、NO3-;一定存在的是:H+、Cl-;可能存在的离子是:K+;
故答案为:Ba2+、OH-、CO32-、NO3-;H+、Cl-;K+;
(2)①中铝离子与氢氧根离子反应生成氢氧化铝沉淀,离子方程式为:Al3++3OH-=Al(OH)3↓;
②中银离子与氯离子反应生成氯化银沉淀,离子方程式为:Ag++Cl-=AgCl↓;
故答案为:Al3++3OH-=Al(OH)3↓、Ag++Cl-=AgCl↓.
点评:本题为离子推断题,考查了离子的检验和离子方程式的书写,明确离子的特性和检验的方法是解题关键,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
实现下列变化,一定要加入其它物质作氧化剂的是( )
| A、CaCO3→CO2 |
| B、NaCl→NaNO3 |
| C、CuO→CuSO4 |
| D、Zn→ZnCl2 |
X溶液滴入Y溶液和Y溶液滴入X溶液现象不同的是( )
| A | B | C | D | |
| X溶液 | MgCl2溶液 | MgCl2溶液 | AlCl3溶液 | AlCl3溶液 |
| Y溶液 | NaOH溶液 | 氨水 | NaOH溶液 | 氨水 |
| A、A | B、B | C、C | D、D |
下列各组离子,无论是在强酸性环境还是在强碱性环境均可以大量共存的是( )
| A、Na+、K+、HCO3-、NO3- |
| B、Ba2+、Mg2+、SO42-、Cl- |
| C、Ag+、K+、Na+、NO3- |
| D、K+、Na+、NO3-、Cl- |
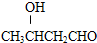
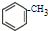
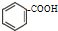
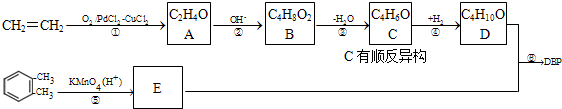

 运用化学反应原理研究氮及其化合物的反应有重要意义.
运用化学反应原理研究氮及其化合物的反应有重要意义.