题目内容
19.自然界中存在一种尖晶石,化学式可表示为MgAl2O4.已知某尖晶石样品中混有Fe2O3,取5.4g该样品,恰好完全溶解于100g一定浓度的盐酸,则该盐酸的质量分数可能为( )| A. | 6.5% | B. | 8.5% | C. | 11.5% | D. | 12.5% |
分析 如果样品中物质完全是MgAl2O4,反应方程式为MgAl2O4+8HCl=MgCl2+2AlCl3+4H2O,如果完全是Fe2O3,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,142gMgAl2O4完全反应消耗8molHCl、160gFe2O3完全反应消耗6molHCl,则如果完全是MgAl2O4,消耗的盐酸最多,如果完全是Fe2O3,消耗的盐酸最少,采用极限法分析解答.
解答 解:如果样品中物质完全是MgAl2O4,反应方程式为MgAl2O4+8HCl=MgCl2+2AlCl3+4H2O,如果完全是Fe2O3,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,142gMgAl2O4完全反应消耗8molHCl、160gFe2O3完全反应消耗6molHCl,则如果完全是MgAl2O4,消耗的盐酸最多,如果完全是Fe2O3,消耗的盐酸最少,
如果完全是MgAl2O4,盐酸的质量分数=$\frac{\frac{5.4g}{142g/mol}×8×36.5g/mol}{100g}$×100%=11.1%;
如果完全是Fe2O3,盐酸的质量分数=$\frac{\frac{5.4g}{160g/mol}×6×36.5g/mol}{100g}$×100%=7.4%,
实际上样品是二者的混合物,所以盐酸浓度应该介于7.4%-11.1%之间,故选B.
点评 本题考查化学方程式的有关计算,为高频考点,明确各个物理量之间的关系式是解本题关键,侧重考查学生分析计算能力,采用极限法分析解答,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
16.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
| A. | 0.1mol/L的盐酸和0.1mol/L的氨水溶液 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 | |
| C. | pH=4的醋酸溶液和pH=10的氢氧化钠溶液 | |
| D. | pH=4的盐酸和pH=l0的氨水 |
10.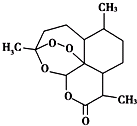 2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.
2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.
如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
 2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.
2015年,中国科学家屠呦呦获得了诺贝尔医学奖,因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.如图是青蒿素的结构,则有关青蒿素的说法中不正确的是( )
| A. | 青蒿素分子式为C15H22O5 | |
| B. | 青蒿素易溶于乙醇、苯 | |
| C. | 青蒿素因含有-O-(醚键)而具有较强的氧化性 | |
| D. | 青蒿素在碱性条件下易发生水解反应 |
7. 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:
(1)E元素在元素周期表的位置是第三周期VIA族,C为氯(填元素名称).
(2)B的最高价氧化物与硝酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O
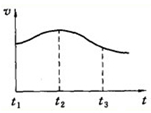
(3)某学生做A与盐酸反应的实验,去除表面的氧化镁等杂质,反应过程中感觉试管外壁发烫,试说明原因镁与盐酸的反应是放热反应,1gA完全反应放出热量为QKJ,则该反应的热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1该学生通过实验测得A与盐酸反应产生气体的速率(v):与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因:镁与盐酸反应放热,温度升高反应速率加快.
 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
(2)B的最高价氧化物与硝酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O
(3)某学生做A与盐酸反应的实验,去除表面的氧化镁等杂质,反应过程中感觉试管外壁发烫,试说明原因镁与盐酸的反应是放热反应,1gA完全反应放出热量为QKJ,则该反应的热化学方程式为Mg(s)+2HCl(aq)=MgCl2(aq)+H2(g)△H1=-24QKJ•mol-1该学生通过实验测得A与盐酸反应产生气体的速率(v):与时间(t)的关系如图所示,则t1~t2时间内反应速率逐渐加快的主要原因:镁与盐酸反应放热,温度升高反应速率加快.
14.下列各有机物的分类或系统命名正确的是( )
| A. | 对甲基苯酚( )属于芳香烃 )属于芳香烃 | B. |  TNT TNT | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. |  3-甲基-1-丁烯 3-甲基-1-丁烯 |
8.化学能与热能、电能等可以相互转化,关于化学能与其它能量相互转化的说法正确的是( )

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 图II所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
9.(1)用正确的序号填空:①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是①; 互为同素异形体的是②;
互为同分异构体的是④; 互为同系物的是⑤
(2)由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
互为同位素的是①; 互为同素异形体的是②;
互为同分异构体的是④; 互为同系物的是⑤
(2)由A、B、C、D四种金属按下表中装置进行实验.
| 装置 |  |  |  |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
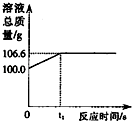 将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:
将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答: