题目内容
16.已知25℃时,电离平衡常数Ka(HF)=3.6×10-4 mol/L,溶度积常数Ksp(CaF2)=1.46×10-10 mol3/L3.现向1L 0.2mol/L HF溶液中加入1L 0.2mol•L-1 CaCl2溶液,则下列说法中,正确的是( )| A. | 25℃时,0.1 mol/L HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中,Ksp(CaF2)=$\frac{1}{{K}_{a}HF}$ | |
| D. | 该体系中有CaF2沉淀产生 |
分析 A.HF酸为弱酸,不能完全电离;
B.Ksp只与温度有关;
C.Ka(HF)=3.6×10-4 mol•L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3•L-3.
D.Qc>Ksp,说明有沉淀产生.
解答 解:A.HF酸为弱酸,不能完全电离,则25℃时,0.1 mol•L-1HF溶液中pH>1,故A错误;
B.Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故B错误;
C.Ka(HF)=3.6×10-4 mol•L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3•L-3,Ka×Ksp≠1,故C错误;
D.两溶液混合后,c(Ca2+)=0.1 mol•L-1,c(F-)=$\sqrt{Ka×c(HF)}$=6×10-3mol/L,则Qc=c2(F-)•c(Ca2+)=(6×10-3mol/L)•0.1 mol•L-1=6×10-4>Ksp,说明有沉淀产生,故D正确;
故选D.
点评 本题考查平衡常数及沉淀的生成,注意利用溶度积判断沉淀能否生成,把握影响平衡常数的因素即可解答,题目难度中等.

练习册系列答案
相关题目
15.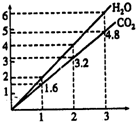 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
 两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体,完全燃烧后得到C02和H2O的物质的量随着混合烃物质的量的变化如图所示.则下列对混合烃的判断正确的是( )| A. | 一定含有CH4 | B. | 一定含有C2H6 | C. | 一定含有C2H4 | D. | 一定不含有C3H4 |
7. 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
 美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知EGCG的结构式如图:有关EGCG的说法错误的是( )| A. | EGCG的分子式为C22H18O11 | |
| B. | EGCG在空气中易氧化,也能与溴水发生加成反应 | |
| C. | 1molEGCG最多可与含9mol氢氧化钠的溶液完全作用 | |
| D. | EGCG能与碳酸钠溶液反应,但不能放出二氧化碳 |
4.A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是( )
| A. | 原子序数:A大于B | B. | A和B可能在同一主族 | ||
| C. | A可能在第2周期ⅣA族 | D. | A肯定是金属元素 |
8.关于化学能与热能的叙述,正确的是( )
| A. | 1mol酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中的能量变化,主要是由化学键的变化引起的 | |
| C. | 燃料电池反应时,化学能升高 | |
| D. | 反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 |

 某同学在实验室研究SO2的性质(夹持装置省略,装置内的空气已排除)
某同学在实验室研究SO2的性质(夹持装置省略,装置内的空气已排除)