题目内容
4.有一种用CO2生产甲醇燃料的方法.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-akJ•mol-1;
CH3OH(g)═CH3OH(l)△H=-bkJ•mol-1;
2H2(g)+O2(g)═2H2O(l)△H=-ckJ•mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-($\frac{3}{2}$c-a-b)kJ•mol-1..
分析 分析目标方程式与已知方程式,始终抓住目标反应和已知反应之间的关系应用数学知识由已知方程式推得目标方程式,依据盖斯定律计算解答.
解答 解:①CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-akJ•mol-1;
②CH3OH(g)═CH3OH(l)△H=-bkJ•mol-1;
③2H2(g)+O2(g)═2H2O(l)△H=-ckJ•mol-1;
$\frac{3}{2}$×③-①-②得:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l),依据盖斯定律得:△H=-($\frac{3}{2}$c-a-b)kJ•mol-1;
所以CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-($\frac{3}{2}$c-a-b)kJ•mol-1.
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+3H2O(l)△H=-($\frac{3}{2}$c-a-b)kJ•mol-1.
点评 本题考查了燃烧热的热化学方程式的书写,明确盖斯定律计算反应热的方法,熟悉燃烧热的概念是解题关键,题目难度不大.

练习册系列答案
相关题目
14.同温同压下,下列各组热化学方程式中,△H1<△H2的是( )
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2 | |
| C. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g);△H2 | |
| D. | 2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2 |
15.将35.0g锌粉与少量浓硫酸在加热的条件充分反应,共收集到混合气体11.2L(标准状况),则过量的锌粉的质量为( )
| A. | 1.0g | B. | 2.0g | C. | 2.5g | D. | 3.5g |
12.已知25℃时,有关弱酸的电离平衡常数如表:
下列有关说法正确的是( )
| 化学式 | CH3COOH | HCN |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 |
| A. | 体积和pH相同的CH3COOH溶液与HCN溶液,分别与足量的Fe反应,HCN溶液产生的H2更多 | |
| B. | 体积和pH相同的CH3COOH溶液与HCN溶液,中和NaOH溶液所消耗NaOH的物质的量相同 | |
| C. | amol•L-1HCN溶液加水稀释后,电离平衡常数减小,加入KCN晶体后,电离平衡常数增大 | |
| D. | 25℃时,在等浓度的CH3COOH溶液与HCN溶液中,水的电离程度前者大 |
19.现有0.1mol•L-1醋酸溶液10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ②c(CH3COOH)增大 ③CH3COO-数目增多 ④c(H+)增大
⑤导电性增强 ⑥$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 ⑦c(OH-)增大.
①电离程度增大 ②c(CH3COOH)增大 ③CH3COO-数目增多 ④c(H+)增大
⑤导电性增强 ⑥$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 ⑦c(OH-)增大.
| A. | ①②③⑦ | B. | ①③⑤⑥ | C. | ①③⑥⑦ | D. | ②④⑤⑥ |
9.已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O.每有1mol Cu(IO3)2参加反应时( )
| A. | 有12 mol KI 被氧化 | B. | 转移11 mol电子 | ||
| C. | 生成CuI 382g | D. | I2只是氧化产物 |
16.下列事实可以证明MOH是弱碱的有( )
①0.1mol/L MOH溶液能使酚酞溶液变红
②常温下,0.1mol/L MOH溶液的pH=12
③0.1mol/L MOH溶液的导电性比0.1mol/L NaOH溶液弱
④等体积的0.1mol/L MOH溶液与0.1mol/L HCl溶液恰好完全反应.
①0.1mol/L MOH溶液能使酚酞溶液变红
②常温下,0.1mol/L MOH溶液的pH=12
③0.1mol/L MOH溶液的导电性比0.1mol/L NaOH溶液弱
④等体积的0.1mol/L MOH溶液与0.1mol/L HCl溶液恰好完全反应.
| A. | .①②③ | B. | .②③ | C. | ②④ | D. | ③④ |
13.下列事实可用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | H2、I2、HI平衡混合气体加压后颜色变深 | |
| C. | 钢铁在潮湿的空气中容易生锈 | |
| D. | 加入催化剂有利于氨催化氧化的反应 |
14.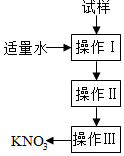 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共只需一次过滤操作 |