题目内容
13.已知稀溶液中,盐酸与氢氧化钠反应生成1molH2O时放热55.6kJ;1mol H2SO4(aq)与1mol Ba(OH)2(aq)反应的△H=-1584.2kJ/mol;则稀溶液中,Na2SO4与BaCl2反应生成1mol BaSO4(s)的反应热等于( )| A. | -1528.6 kJ/mol | B. | -1639.8 kJ/mol | C. | -1473 kJ/mol | D. | -1695.4 kJ/mol |
分析 由题意可得:①H+(aq)+OH-(aq)═H2O(l)△H1=-55.6kJ•mol-1
②2H+(aq)+2OH-(aq)+Ba2+(aq)+SO42-(aq)═BaSO4(s)+2H2O(l)△H=-1584.2kJ•mol-1
根盖斯定律,则反应Ba2+(aq)+SO42-(aq)═BaSO4(s)等于②-①×2,据此计算.
解答 解:由:①H+(aq)+OH-(aq)═H2O(l)△H1=-55.6kJ•mol-1
②2H+(aq)+2OH-(aq)+Ba2+(aq)+SO42-(aq)═BaSO4(s)+2H2O(l)△H=-1584.2kJ•mol-1
根盖斯定律,则反应Ba2+(aq)+SO42-(aq)═BaSO4(s)等于②-①×2,所以焓变=-1584.2kJ•mol-1-2×(-55.6kJ•mol-1)=-1473 kJ•mol-1;
故选:C.
点评 本题考查了盖斯定律的运用,注意热化学方程式的含义的理解应用,题目较简单.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
3.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1molCl2参加化学反应获得的电子数都是2NA | |
| B. | 6.4 gO2与O3的混合物中所含O原子数一定为0.4NA | |
| C. | 含4nmol HCl的浓盐酸与足量的MnO2加热反应,生成的Cl2分子数为nNA | |
| D. | 1mol某气体的体积为22.4L,该气体的状况一定是标准状况 |
4.下列离子方程式书写正确的是( )
| A. | Na投入到足量的盐酸中:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 三氯化铁溶液中加入铜粉:Fe3++Cu═Fe2++Cu2 | |
| D. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
1.下列说法中,正确的是( )
| A. | 有机物都能燃烧生成二氧化碳和水,且受热不易分解 | |
| B. | 有机物大多数难溶于水而易溶于汽、四氯化碳等有机溶剂 | |
| C. | 有机物都是非电解质且熔点、沸点较低 | |
| D. | 有机化学反应都较复杂,且副反应多,反应速率慢 |
18.在某恒温恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)△H=-Q kJ/mol(Q>0),保持其它条件不变,只改变起始添加量,测得相关数据如表所示
下列说法中错误的是( )
| 起始加入量(mol) | 平衡时 | ||||
| A | B | C | A或C转化率(%) | C的物质的量分数(%) | 放出或吸收热量(kJ) |
| 1 | 1 | 0 | α1 | φ1 | Q1 |
| 0 | 0 | 2 | α2 | φ2 | Q2 |
| 2 | 2 | 0 | α3 | φ3 | Q3 |
| A. | α1+α2=1; φ2=φ1 | B. | α1=α3;Q1+Q2=Q | ||
| C. | φ3=φ1=φ2; Q3=2Q1 | D. | φ3=2φ1; Q3=Q1 |
3.苯燃烧热的热化学方程式为C6H6(l)+$\frac{15}{2}$O2(g)=6CO2(g)+3H2O(l)△H=-3260kJ•mol-1,设阿伏伽德罗常数的值为NA,下列说法正确的是( )
| A. | 断裂3NA个碳碳双键时,放出3260kJ的热量 | |
| B. | 消耗336L O2时,放出6520kJ的热量 | |
| C. | 转移30NA个电子时,放出3260kJ的热量 | |
| D. | 生成3NA个气态水分子时,放出3260kJ的热量 |

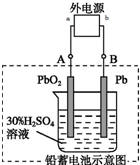 铅蓄电池是典型的可充电电池,电池的两极材料分别是Pb、PbO2,电解质H2SO4.请回答下列问题.
铅蓄电池是典型的可充电电池,电池的两极材料分别是Pb、PbO2,电解质H2SO4.请回答下列问题.