题目内容
2.用20.0g烧碱配制成500mL溶液,其物质的量浓度为1mol•L-1从中取出10mL,其物质的量浓度为1mol•L-1,这10mL中含溶质0.4g.其中含Na+的物质的量是0.01mol.分析 根据n=$\frac{m}{M}$以及c=$\frac{n}{V}$计算溶液的物质的量浓度;溶液为均一稳定分散系,取出任意体积都和原溶液浓度相等;根据n=cVM计算出含有溶质的质量;根据n=cV计算出含有钠离子的物质的量.
解答 解:20g烧碱的物质的量为:n=$\frac{20g}{40g/mol}$=0.5mol,则c=$\frac{0.5mol}{0.5L}$=1mol/L;
溶液为均一稳定分散系,取出任意体积都和原溶液浓度相等,从中取出10mL,其物质的量浓度为1mol/L;
该10mL取出的溶液中含有溶质的质量为:m=nM=cVM=0.01L×1mol/L×40g/mol=0.4g;
其中含Na+的物质的量为:1mol/L×0.01L=0.01mol,
故答案为:1;1;0.4;0.01.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,注意熟练掌握物质的量浓度的概念及计算方法.

练习册系列答案
相关题目
12.能表示阿伏加德罗常数数值的是( )
| A. | 1mol金属钠含有的电子数 | |
| B. | 1L 1mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4L四氯化碳所含的分子数 | |
| D. | 0.012kg12C所含的原子数 |
13.已知稀溶液中,盐酸与氢氧化钠反应生成1molH2O时放热55.6kJ;1mol H2SO4(aq)与1mol Ba(OH)2(aq)反应的△H=-1584.2kJ/mol;则稀溶液中,Na2SO4与BaCl2反应生成1mol BaSO4(s)的反应热等于( )
| A. | -1528.6 kJ/mol | B. | -1639.8 kJ/mol | C. | -1473 kJ/mol | D. | -1695.4 kJ/mol |
10.下列说法正确的是( )
| A. | 物质发生化学反应时不一定都伴随着能量变化 | |
| B. | 一个化学反应中,当反应物总能量大于反应产物总能量时,反应放热,△H>0 | |
| C. | 在加热条件下发生的反应均为吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
7.下列实验操作中,主要是从安全因素考虑的是( )
a.点燃可燃性气体前检验气体纯度
b.给试管里的液体加热时,试管口应略向上倾斜,外壁干燥后再预热
c.给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热
d.用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜
e.实验室用高锰酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯.
a.点燃可燃性气体前检验气体纯度
b.给试管里的液体加热时,试管口应略向上倾斜,外壁干燥后再预热
c.给试管里的固体加热时,试管口应略向下倾斜,外壁干燥后再预热
d.用氢气还原氧化铜时,应先通一会儿氢气,再加热氧化铜
e.实验室用高锰酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯.
| A. | abc | B. | ade | C. | dce | D. | 全部 |
14.下列反应的离子方程式正确的是( )
| A. | 澄清的石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |
11.VL K2SO4溶液中,含有K+mg,则溶液中SO42-的物质的量浓度为( )
| A. | $\frac{39m}{V}$mol•L-1 | B. | $\frac{2m}{39V}$mol•L-1 | C. | $\frac{m}{39V}$mol•L-1 | D. | $\frac{m}{78V}$mol•L-1 |
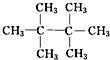
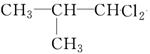 、
、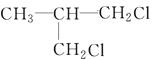 、
、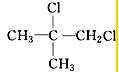 .
.