题目内容
4.下列离子方程式书写正确的是( )| A. | Na投入到足量的盐酸中:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 三氯化铁溶液中加入铜粉:Fe3++Cu═Fe2++Cu2 | |
| D. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
分析 A.酸性条件下,氢离子优先于钠反应;
B.氨水为弱碱,二者反应生成氢氧化铝沉淀;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:A.Na投入到足量的盐酸中,反应生成氯化钠和氢气,正确的离子方程式为:2Na+2H+═2Na++H2↑,故A错误;
B.氨水与氯化铝反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.三氯化铁溶液中加入铜粉,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故C错误;
D.氯气通入冷的氢氧化钠溶液,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度中等,明确离子方程式的书写原则为解答关键,注意熟练掌握判断离子方程式正误时的常用方法,试题培养了学生的灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.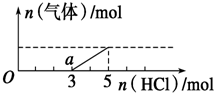 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 常温下,a点溶液pH>7 | |
| C. | 标准状况下,通入CO2的体积为4.48L | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol/L |
12.能表示阿伏加德罗常数数值的是( )
| A. | 1mol金属钠含有的电子数 | |
| B. | 1L 1mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4L四氯化碳所含的分子数 | |
| D. | 0.012kg12C所含的原子数 |
19.按照物质的树状分类和交叉分类,硫酸应属于( )
①酸 ②能导电 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦强电解质.
①酸 ②能导电 ③含氧酸 ④混合物 ⑤化合物 ⑥二元酸 ⑦强电解质.
| A. | ①②③④⑦ | B. | ①③⑤⑥⑦ | C. | ①③④⑥⑦ | D. | ②③⑤⑥⑦ |
9.标准状况下,将20LCO2和CO的混合气全通过足量的Na2O2粉末,在相同状况下,气体体积减少到16L,则原混合气体中CO的体积为( )
| A. | 4L | B. | 8L | C. | 12L | D. | 16L |
13.已知稀溶液中,盐酸与氢氧化钠反应生成1molH2O时放热55.6kJ;1mol H2SO4(aq)与1mol Ba(OH)2(aq)反应的△H=-1584.2kJ/mol;则稀溶液中,Na2SO4与BaCl2反应生成1mol BaSO4(s)的反应热等于( )
| A. | -1528.6 kJ/mol | B. | -1639.8 kJ/mol | C. | -1473 kJ/mol | D. | -1695.4 kJ/mol |
14.下列反应的离子方程式正确的是( )
| A. | 澄清的石灰水跟稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-=BaSO4↓ | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | 往澄清石灰水中通入少量二氧化碳气体:CO2+OH-=HCO3- |