题目内容
下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: .
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 .
(3)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填“共价”或“离子”)化合物.
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是 (要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: .
(7)写出⑥的最高价氧化物的水化物和①的单质反应的化学方程式: .
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)最高价氧化物是两性氧化物的元素是
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:
(7)写出⑥的最高价氧化物的水化物和①的单质反应的化学方程式:
考点:原子结构与元素的性质,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①~⑩元素分别是C、N、O、Na、Al、S、Cl、Ar、K、Br元素,
(1)元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(2)最高价氧化物是两性氧化物的元素是Al,氧化铝和NaOH溶液反应生成偏铝酸钠和水;
(3)元素④与⑥通过得失电子生成化合物Na2S,该化合物属于离子化合物;
(4)①与⑦形成的化合物CCl4,不同非金属元素之间形成极性键;
(5)离子的电子层数越多,其离子半径越大,相同电子层数的离子,离子半径随着原子序数增大而减小;
(6)元素③的氢化物是H2O,元素⑦的单质是Cl2,常温下二者反应生成HCl和HClO;
(7)⑥的最高价氧化物的水化物是H2SO4,①的单质是C,二者发生氧化还原反应.
(1)元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(2)最高价氧化物是两性氧化物的元素是Al,氧化铝和NaOH溶液反应生成偏铝酸钠和水;
(3)元素④与⑥通过得失电子生成化合物Na2S,该化合物属于离子化合物;
(4)①与⑦形成的化合物CCl4,不同非金属元素之间形成极性键;
(5)离子的电子层数越多,其离子半径越大,相同电子层数的离子,离子半径随着原子序数增大而减小;
(6)元素③的氢化物是H2O,元素⑦的单质是Cl2,常温下二者反应生成HCl和HClO;
(7)⑥的最高价氧化物的水化物是H2SO4,①的单质是C,二者发生氧化还原反应.
解答:
解:根据元素在周期表中的位置知,①~⑩元素分别是C、N、O、Na、Al、S、Cl、Ar、K、Br元素,
(1)这几种元素中非金属性最强的是Cl元素,其最高价氧化物的水化物是HClO4,金属性最强的是K元素,其最高价氧化物的水化物是KOH,故答案为:HClO4;KOH;
(2)最高价氧化物是两性氧化物的元素是Al,氧化铝和NaOH溶液反应生成偏铝酸钠和水,离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(3)元素④与⑥通过得失电子生成化合物Na2S,其形成过程为 ,该化合物中只含离子键,所以属于离子化合物,故答案为:
,该化合物中只含离子键,所以属于离子化合物,故答案为: ;离子;
;离子;
(4)①与⑦形成的化合物CCl4,其电子式为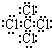 ,C原子和Cl原子之间形成极性键,故答案为:
,C原子和Cl原子之间形成极性键,故答案为: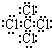 ;极性;
;极性;
(5)离子的电子层数越多,其离子半径越大,相同电子层数的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是S2->Cl->O2-,故答案为:S2->Cl->O2-;
(6)元素③的氢化物是H2O,元素⑦的单质是Cl2,常温下二者反应生成HCl和HClO,离子方程式为H2O+Cl2=H++Cl-+HClO,故答案为:H2O+Cl2=H++Cl-+HClO;
(7)⑥的最高价氧化物的水化物是H2SO4,①的单质是C,二者发生氧化还原反应,反应方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O.
(1)这几种元素中非金属性最强的是Cl元素,其最高价氧化物的水化物是HClO4,金属性最强的是K元素,其最高价氧化物的水化物是KOH,故答案为:HClO4;KOH;
(2)最高价氧化物是两性氧化物的元素是Al,氧化铝和NaOH溶液反应生成偏铝酸钠和水,离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al;Al2O3+2OH-=2AlO2-+H2O;
(3)元素④与⑥通过得失电子生成化合物Na2S,其形成过程为
 ,该化合物中只含离子键,所以属于离子化合物,故答案为:
,该化合物中只含离子键,所以属于离子化合物,故答案为: ;离子;
;离子;(4)①与⑦形成的化合物CCl4,其电子式为
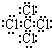 ,C原子和Cl原子之间形成极性键,故答案为:
,C原子和Cl原子之间形成极性键,故答案为: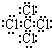 ;极性;
;极性;(5)离子的电子层数越多,其离子半径越大,相同电子层数的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是S2->Cl->O2-,故答案为:S2->Cl->O2-;
(6)元素③的氢化物是H2O,元素⑦的单质是Cl2,常温下二者反应生成HCl和HClO,离子方程式为H2O+Cl2=H++Cl-+HClO,故答案为:H2O+Cl2=H++Cl-+HClO;
(7)⑥的最高价氧化物的水化物是H2SO4,①的单质是C,二者发生氧化还原反应,反应方程式为C+2H2SO4(浓)
| ||
| ||
点评:本题考查了元素周期表和元素周期律综合应用,根据物质的性质、物质结构及元素周期律分析解答,难点是用电子式表示物质形成过程,要注意电子式的书写方法,题目难度中等.

练习册系列答案
相关题目
下列属于同分异构体的是( )
A、
| ||||
| B、SO2和SO3 | ||||
| C、CH4和C4H10 | ||||
| D、CO(NH2)2和NH4CNO |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1 NaHCO3溶液中:c(H+)+2c(H2CO3)=2c(CO32-)+c(OH-) |
| B、0.1mol?L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| C、将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) |
| D、pH相等的①CH3COONa ②C6H5ONa ③Na2CO3 ④NaOH四种溶液的物质的量浓度大小:①>②>③>④ |
下列说法不正确的是( )
| A、汤姆生、卢瑟福、威尔等科学家对原子结构模型的提出作出了很大贡献 |
B、海水提取单质镁的主要步骤为: |
| C、酸碱盐各物质的组成中一定都含有非金属元素 |
| D、严格地讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收 |


 (1)铝可将水中的NO3-转化为N2,从而消除污染.该反应中涉及的粒子有:H2O、Al、AlO2-、Al(OH)3、NO3-、N2,请将这些粒子中除NO3-以外的粒子填入以下空格内(要配平)
(1)铝可将水中的NO3-转化为N2,从而消除污染.该反应中涉及的粒子有:H2O、Al、AlO2-、Al(OH)3、NO3-、N2,请将这些粒子中除NO3-以外的粒子填入以下空格内(要配平)