题目内容
1.氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水反应,其制取过程的相关反应如下:S(s)+Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$SCl2(l) (Ⅰ)
SCl2(l)+SO3(l)═SOCl2(l)+SO2(g)(Ⅱ)
已知二氯化硫(SCl2)熔点-78°C,沸点59°C,如图是实验室由氯气与硫合成二氯化硫的装置.

(1)仪器组装完成后,检查装置气密性的操作是关闭分液漏斗活塞,在干燥管末端连接一个排尽空气的气球,对A中烧瓶微热,若气球膨大,停止加热,气球恢复原状,说明装置气密性良好;反应前要先排尽系统中空气,此做法目的是防止加热硫粉时,空气中的氧气与硫粉反应.
(2)装置D中玻璃仪器d的名称是蒸馏烧瓶,向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是增大反应物接触面积(或使反应更加充分).
(3)实验时,为防止E中液体挥发,可采取的措施是将锥形瓶放入冰水中冷却(冷水浴或冰水浴).装置F(盛放碱石灰)的作用是一是防止空气中水蒸气进入,二是吸收多余的氯气.
(4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使原子的利用率达到100%,三者的物质的量比为2:3:1;
已知:SOCl2+4NaOH═Na2SO3+2NaCl+2H2O.
供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成.
分析 装置A制备氯气,装置B吸收氯气的中HCl,装置C干燥氯气,D装置生成SCl2,E装置收集SCl2,F装置吸收多余的氯气,吸收空气中水蒸气,防止进入E中,
(1)根据装置的气体的压强差检验装置的气密性;加热硫粉时,空气中的氧气能与硫粉反应;
(2)根据装置图可知装置D中玻璃仪器的名称为蒸馏烧瓶;将硫粉加热使之融化,轻轻摇动使硫附着在容器的内壁,可以增大硫的表面积;
(3)二氯化硫(SCl2)的沸点低,易挥发,可以用冰水冷却;防止空气中水蒸气进入;
(4)根据产物方程式利用质量守恒定律判断硫黄、液氯和液体三氧化硫的物质的量之比;
由SOCl2与氢氧化钠溶液反应可知,SOCl2水解后分解得到SO2、HCl,利用品红溶液检验有二氧化硫生成,用硝酸银溶液检验氯离子.
解答 解:装置A制备氯气,装置B吸收氯气的中HCl,装置C干燥氯气,D装置生成SCl2,E装置收集SCl2,F装置吸收多余的氯气,吸收空气中水蒸气,防止进入E中,
(1)仪器组装完成后,检查装置气密性的操作是:(关闭分液漏斗活塞) 在干燥管末端连接一个排尽空气的气球,对A中烧瓶微热,若气球膨大,停止加热,气球恢复原状,说明装置气密性良好;加热硫粉时,空气中的氧气与硫粉反应,应先排尽系统中空气,
故答案为:关闭分液漏斗活塞,在干燥管末端连接一个排尽空气的气球,对A中烧瓶微热,若气球膨大,停止加热,气球恢复原状,说明装置气密性良好;防止加热硫粉时,空气中的氧气与硫粉反应;
(2)根据装置图可知装置D中玻璃仪器的名称为蒸馏烧瓶,热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,可以增大反应物接触面积,使反应更加充分,
故答案为:蒸馏烧瓶; 增大反应物接触面积(或使反应更加充分);
(3)二氯化硫(SCl2)的沸点低,为防止SCl2中液体挥发,可采取将锥形瓶放入冰水中冷却等措施,装置F(盛放碱石灰)有两个作用:一是防止空气中水蒸气进入;二是吸收多余的氯气,
故答案为将锥形瓶放入冰水中冷却(冷水浴或冰水浴);一是防止空气中水蒸气进入;二是吸收多余的氯气;
(4)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则反应的方程式为:2S+3Cl2+SO3$\frac{\underline{\;一定条件下\;}}{\;}$3SOCl2,所以三者的物质的量比为2:3:1;
由SOCl2与氢氧化钠溶液反应可知,SOCl2水解后分解得到SO2、HCl,利用品红溶液检验有二氧化硫生成,用硝酸银溶液检验氯离子,具体实验操作为:分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成,
故答案为:2:3:1;分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成.
点评 本题考查化学实验制备方案,题目难度中等,涉及基本操作、对操作与装置的分析评价、物质检验等知识,明确实验目的、实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案| A. | 该电池的负极锌发生还原反应 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.lmol Zn完全溶解时,流经电解液的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为 MnO2+e-+H20═MnO(OH)+OH- |
| 选项 | 古诗或谚语 | 含有的化学反应类型 |
| A | 爆竹声中除旧岁,春风送暖入屠苏 | 复分解反应 |
| B | 千锤万凿出深山,烈火焚烧若等闲 | 分解反应 |
| C | 春蚕到死丝方尽,蜡炬成灰泪始干 | 化合反应 |
| D | 真金不怕火,怕火便是铜 | 置换分解反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | C8H10含苯环的烃同分异构体有3种 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯 | |
| C. | 苯中含有杂质苯酚,可用浓溴水来除杂 | |
| D. | 丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物是同系物 |
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
| A. | 除去蛋白质中的葡萄糖,可以用浓硫酸铵溶液盐析过滤方法提纯 | |
| B. | 双氧水中滴加氯化铁溶液立即产生气泡,说明氯化铁的氧化性比过氧化氢强 | |
| C. | 锂钒氧化物蓄电池放电时电池的总反应式为:V2O5+xLi═LixV2O5.供电时Li+向正极移动,充电时阳极的电极反应式为:LixV2O5-xe-═V2O5+xLi+ | |
| D. | 常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因是NH4+结合OH-使沉淀溶解平衡发生移动 |
| A. | Fe2+ Na+ NO3- Cl- | B. | Ba2+ Cu2+ NO${\;}_{3}^{-}$ Cl- | ||
| C. | SO42- SO3- NH4+ Na+ | D. | Mg2+ Na+ Br- ClO- |
| A. | N2比O2的化学性质稳定 | B. | F2、Cl2、Br2、I2的沸点逐渐升高 | ||
| C. | 金刚石的熔点比晶体硅高 | D. | HF、HCl、HBr、HI的热稳定性依减弱 |
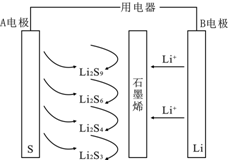 石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )| A. | 放电时,Li+向负极迁移 | |
| B. | A电极上发生的一个电极反应为:2Li++6S+2e-=Li2S6 | |
| C. | 若对该电池充电,B电极接电源正极 | |
| D. | B电极发生还原反应 |