题目内容
1.硫代硫酸钠(Na2S2O3)用于电镀、鞣制皮革,还用作化工行业的还原剂、棉织品漂白后的脱氯剂等.某研究小组采用2Na2S+Na2CO3+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3+CO2,通过如图1装置(夹持仪器省略)进行实验.请根据以上信息,回答下列问题:
(1)C中倒挂漏斗能否改成插入溶液中的直导管,理由是可以改成直导管.由于通入的空气中含有大量不参与反应的氮气等,不会产生倒吸现象.
(2)B中采用含有不同比例的Na2S和Na2CO3溶液进行三组实验,其中有一组溶液变浑浊,生成的固体物质是硫(S),本组实验的B装置中c(Na2S)/c(Na2CO3)是三组实验中最大(大、小).
(3)若要通过抽滤装置操作使上述混浊液变澄清时,布氏漏斗的漏斗管插入单孔橡胶塞与吸滤瓶相接.橡胶塞插入吸滤瓶内的部分不得超过塞子高度的$\frac{2}{3}$;向漏斗中加入溶液,溶液量不应超过漏斗容量的$\frac{2}{3}$;当吸滤瓶中液面快达到支管口位置时,应拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液.
(4)工厂对排放污水中Ba2+的浓度测定时可以采用如下流程:
(已知:I2+2S2O32一═2I-+S4O62-)

①写出在BaCrO4沉淀中加入过量HCl和HI混合溶液反应的离子方程式2BaCrO4+16H++6I-=2Ba2++2Cr3++8H2O+3I2;
②用标准硫代硫酸钠溶液滴定①中所得的溶液时,可以用淀粉溶液为指示剂进行滴定,则到达滴定终点的现象是滴入最后一滴溶液后,锥形瓶内溶液由蓝色变为无色且半分钟不变色;
③若标准硫代硫酸钠溶液的浓度为0.0020mol•L-1,消耗该溶液体积如图2所示,则废水中Ba2+的浓度为7.3×10-4mol/L.
分析 通过如图1装置实验具体操作步骤为:第一个A装置为二氧化硫的制取装置煅烧黄铁矿:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,B装置为Na2S2O3的生成装置2Na2S+Na2CO3+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3+CO2,;C装置为尾气吸收装置,吸收二氧化硫和二氧化碳等酸性气体,抽滤B所得的溶液变澄清.
(1)该反应源源不断通入空气与黄铁矿反应制取二氧化硫,由于通入的空气中含有大量不参与反应的氮气等,能防止C中压强骤然减小,可以将倒挂漏斗改成直导管插入溶液中;
(2)硫化钠过量,硫化钠与二氧化硫和水反应生成硫,硫代硫酸钠在酸性条件下会生成S和二氧化硫;因部分硫元素转化为硫单质,所以本组实验的B装置中c(Na2S)/c(Na2CO3)是三组实验中最大;
(3)抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快,橡胶塞插入吸滤瓶内的部分不得超过塞子高度的$\frac{2}{3}$,漏斗中溶液量不应超过漏斗容量的$\frac{2}{3}$,当吸滤瓶中液面快达到支管口位置时,应拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液;
(4)①碘离子具有还原性,+6铬具有氧化性,两者发生氧化还原反应;
②碘单质遇淀粉试液变蓝色;
③V(Na2S2O3)=(27.60-0.10)mL,根据该反应中2S2O32-~-I2~$\frac{2}{3}$Ba2+计算钡离子的物质的量浓度.
解答 解:(1)图1装置中A装置为二氧化硫的制取装置煅烧黄铁矿:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,需源源不断通入空气与黄铁矿反应制取二氧化硫,空气中含有大量不参与反应的氮气等,最终进入C装置,C中压强不会骤然减小,所以可以将防止倒吸的倒挂漏斗改成直导管插入溶液中,
故答案为:可以改成直导管.由于通入的空气中含有大量不参与反应的氮气等,不会产生倒吸现象;
(2)B中采用含有不同比例的Na2S和Na2CO3溶液进行三组实验,其中有一组溶液变浑浊,生成的固体物质是硫(S),是因为发生Na2S+SO2+H2O=H2S+Na2SO3,SO2+2H2S=3S↓+2H2O,且Na2S2O3在酸性条件下会生成S和二氧化硫,其反应的离子方程式为:S2O32-+2H+=S↓+H2O+SO2↑,
故答案为:硫(S);
(3)减压过滤,利用大气压强原理,用减小压力的方法加快过滤的速率,抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,为便于吸滤,布氏漏斗上的橡胶塞插入吸滤瓶内不能太长,为了防止液体沿着漏斗下端从支管口抽进去,需布氏漏斗的颈口斜面与吸滤瓶支管口相对,安全瓶内左侧导管不能太长,所以布氏漏斗的漏斗管插入单孔橡胶塞与吸滤瓶相接.橡胶塞插入吸滤瓶内的部分不得超过塞子高度的$\frac{2}{3}$,向漏斗中加入溶液,溶液量不应超过漏斗容量的$\frac{2}{3}$;当吸滤瓶中液面快达到支管口位置时,应拔掉吸滤瓶上的橡皮管,从吸滤瓶上口倒出溶液,而不能从支管口倒出,
故答案为:$\frac{2}{3}$;$\frac{2}{3}$; 吸滤瓶上口;
(4)①BaCrO4沉淀中+6铬具有氧化性,HI混合溶液中-1价的碘离子具有还原性,两者发生氧化还原反应,生成+3价铬和单质碘,反应为:2BaCrO4+16H++6I-=2Ba2++2Cr3++8H2O+3I2,
故答案为:2BaCrO4+16H++6I-=2Ba2++2Cr3++8H2O+3I2;
②碘遇淀粉试液变蓝色,如果滴入最后一滴,溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,
故答案为:滴入最后一滴溶液后,锥形瓶内溶液由蓝色变为无色且半分钟不变色;
③V(Na2S2O3)=(27.60-0.10)mL=27.50mL,设碘的物质的量浓度是xmol/L,
I2------2S2O32-
1mol 2mol
xmol (0.0275×0.0020)mol 1mol:2mol=xmol:(0.0275×0.0020)mol 解得:x=2.75×10-5mol,依据2BaCrO4+16H++6I-=2Ba2++2Cr3++8H2O+3I2,
得关系式:2S2O32-~-I2~$\frac{2}{3}$Ba2+,则废水中Ba2+的浓度为C=$\frac{n}{v}$=$\frac{2.75×1{0}^{-5}mol×\frac{2}{3}}{25×1{0}^{-3}L}$≈7.3×10-4mol/L,
故答案为:7.3×10-4mol/L.
点评 本题考查了物质制备实验方案的设计和制备过程分析应用,理解工艺流程图、明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | 钾离子 | B. | 氯离子 | C. | 氯原子 | D. | 氧原子 |
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 标准状况下,2.24L Cl2与过量的稀FeI2溶液反应,转移电子总数为0.1NA |
| A. | 1mol H2O所含电子数为10NA | |
| B. | 1mol Al与足量的稀盐酸溶液反应生成氢气1.5mol | |
| C. | 在标准状况下,0.5NA Cl2所占的体积约是11.2L | |
| D. | 在非标准状况下,22.4L O2含有的分子数一定不是NA |
| A. | 1:1 | B. | 1:2 | C. | 1:5 | D. | 2:3 |
 S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.已知:①S2Cl2易与水反应;②300℃以上完全分解;③微热的情况下S2Cl2能被过量Cl2氧化S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ 2SCl2;④有关物质的熔沸点如下:
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
①CS2+3C12$\frac{\underline{\;95-100℃\;}}{\;}$CC14+S2Cl2; ②2S+Cl2$\frac{\underline{\;111-140℃\;}}{\;}$S2Cl2.
(1)若实验室选择如图装置(部分夹持装置已略去)来制备S2Cl2,其反应原理是上述中的①(填写序号);上图中尾气处理装置不够完善,改进后的装置应起到的作用是:在D、E之间再加一个干燥装置,同时要能吸收尾气、防倒吸.利用改进后的正确装置进行实验,请回答以下问题
(2)为了提高产品S2Cl2的纯度,实验操作的关键是控制好温度和控制浓盐酸的滴速不能太快.
(3)该实验的操作顺序为:①③②⑤④(用序号表示).
①点燃酒精灯A ②点燃酒精灯D ③通冷凝水 ④熄灭酒精灯A ⑤熄灭酒精灯D
(4)D装置中冲凝管的作用是:冷凝回流、导气;反应结束后,从D装置锥形瓶内的混合物中分离出产物的方法是:蒸馏;某同学取少量产物,小心加入适量水中,观察到有白雾,黄色沉淀、产生的无色气体能使品红
溶液褪色,该同学据此判断.上述实验确有S2Cl2生成,写出S2Cl2与水反应的化学方程式:2S2Cl2+2H2O=S↓+SO2↑+4HCl
(5)S2Cl2中每个原子的最外层都具有8电子结构,请写出S2Cl2的电子式:
 .
.  $→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$→_{过滤}^{调节PH_{3}-4}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O $\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O
$\stackrel{40℃-50℃}{→}$CuSO4溶液$→_{过滤}^{结晶}$CuSO4•5H2O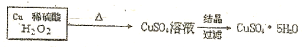 .
.
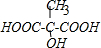 .
.