题目内容
5.将0.1mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时都会引起( )| A. | CH3COOH电离程度变大 | B. | 溶液pH变大 | ||
| C. | 溶液中c(H+)减小 | D. | 溶液的导电能力减弱 |
分析 CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度减小,溶液的pH增大,导电能力减弱,溶液中c(H+)减小;CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,溶液的PH增大,导电能力增强,溶液中c(H+)减小.
解答 解:A.CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,故A错误;
B.CH3COOH溶液加水稀释,平衡向正反应方向移动,溶液的PH增加,CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,溶液的pH增加,故B正确;
C.加水稀释,促进醋酸电离,但溶液中氢离子浓度减小,加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,氢离子浓度减小,温度不变,水的离子积常数不变,所以氢氧根离子浓度增大,故C正确;
D.CH3COOH溶液加水稀释,离子浓度减小,溶液的导电能力减弱,加入少量CH3COONa晶体时,离子浓度增大,溶液的导电能力增强,故D错误;
故选BC.
点评 本题考查外界条件对电离平衡的影响,重点考查离子浓度以及同离子效应对电离平衡的影响,注意总结影响因素以及平衡移动的方向的判断.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
13.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | 沸点:CO>N2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 还原性:HF>HCl>HBr>HI | D. | 沸点:HF>H2O>NH3 |
20.下列说法中正确的是( )
| A. | 同周期元素的电子层数都相同 | |
| B. | 同族元素的最外层电子数一定相同 | |
| C. | 最外层电子数相同的元素都在同一族 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
10.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol NaHSO4晶体中离子总数为2NA | |
| B. | 4.4g 14CO2含中子数为2.4NA | |
| C. | 0.3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| D. | 1 molFe在氧气中燃烧失去的电子数为3NA |
17.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
| A. | C$\stackrel{在空气中燃烧}{→}$ CO$\stackrel{CuO△}{→}$ CO2$\stackrel{NaOH溶液}{→}$ Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$ Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$ Cu(OH)2 | |
| C. | Fe $\stackrel{点燃}{→}$ Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$ Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$ Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}溶液}{→}$ NaOH溶液 |
14.为确定某溶液的离子组成,分别进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
| A. | 不能确定HCO3-离子是否存在 | B. | 可能有CO32-离子 | ||
| C. | 一定有Cl-离子存在 | D. | 一定有SO42-离子 |
15.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)元素T的最高价含氧酸具有强酸性;T在周期表中的位置是第三周期第ⅦA族.
(2)化合物甲的分子由两个J原子和两个氢原子构成,甲的电子式是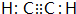 .
.
(3)一定条件下,R元素的最高价氧化物乙在固定容积的密闭容器中发生分解反应(△H>0),达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增,y递减的是ac(选填序号)
(4)L的最简单气态氢化物丙的水溶液显碱性,在微电子工业中,丙的水溶液可作H2O2的清除剂,反应的产物不污染环境,其化学方程式为NH3+3H2O2=N2+6H2O.
(5)在298K下,J、M的单质各1mol完全燃烧,分别放出热量以akJ和bkJ时.又知一定条件下,M的单质能将J从它的最高价氧化物中置换出来,写出此置换反应的热化学方程式:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(+3a-4b)kJ/mol.(注:题中所设单质均为最稳定单质)
(6)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是H2、CaCO3,阳极也生成气体和沉淀,写出阳极的电极反应式Al-3e-+3HCO3-=Al(OH)3+3CO2↑.
| J | ||||
| R |
(2)化合物甲的分子由两个J原子和两个氢原子构成,甲的电子式是
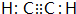 .
.(3)一定条件下,R元素的最高价氧化物乙在固定容积的密闭容器中发生分解反应(△H>0),达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增,y递减的是ac(选填序号)
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入氧气 | 加入乙的物质 |
| y | 乙的物质的量 | 平衡常数K | 乙的转化率 | 生成物物质的量总和 |
(5)在298K下,J、M的单质各1mol完全燃烧,分别放出热量以akJ和bkJ时.又知一定条件下,M的单质能将J从它的最高价氧化物中置换出来,写出此置换反应的热化学方程式:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(+3a-4b)kJ/mol.(注:题中所设单质均为最稳定单质)
(6)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是H2、CaCO3,阳极也生成气体和沉淀,写出阳极的电极反应式Al-3e-+3HCO3-=Al(OH)3+3CO2↑.