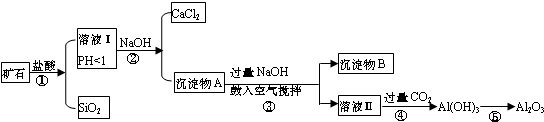
题目内容
15.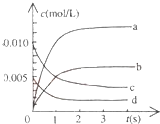 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s)
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1molNO2,热量变化为56.4kJ.但是该同学由于疏忽,忘记注明“+”、“-”.根据题目信息,该反应的热化学方程式为2NO(g)+O2(g)?2NO2(g)△H=-112.8kJ/mol.
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
分析 (1)化学平衡常数,是指在一定温度下,可逆反应都达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写;
(2)由表中数据可知,平衡时c(NO)=$\frac{0.007mol}{2}$=0.0035mol/L,由方程式2NO(g)+O2(g)?2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,据此判断表示NO2的浓度变化的曲线,
由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,根据v=$\frac{△c}{△t}$计算v(NO),再根据速率之比等于化学计量数之比计算v(O2);
(3)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(4)K(300℃)>K(350℃),说明升高温度平衡向逆反应移动,说明正反应是放热反应,然后根据25℃时生成1molNO2放出热量为56.4kJ写出反应的化学方程式;
(5)根据外界条件对反应速率与平衡的移动分析解答.
解答 解(1)可逆反应2NO(g)+O2(g)?2NO2(g)的平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)•c({O}_{2})}$;
(2)由方程式2NO(g)+O2(g)?2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,由表中数据可知,平衡时△c(NO)=$\frac{0.02mol-0.007mol}{2L}$=0.00625mol/L,曲线b平衡时的浓度为0.00625mol/L,故曲线b表示NO2的浓度变化;
由图中数据可知2s内,NO的浓度变化量为0.01mol/L-0.004mol/L=0.006mol/L,故v(NO)=$\frac{0.006mol/L}{2s}$=0.003mol/(L•s),根据速率之比等于化学计量数之比,故v(O2)=$\frac{1}{2}$v(NO)=$\frac{1}{2}$×0.003mol/(L•s)=0.0015mol/(L•s),
故答案为:b;0.0015mol/(L•s);
(3)a.未指明正逆速率,若都为同一方向速率,始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,故a错误;
b.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,故b正确;
c.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),说明到达平衡,故c正确;
d.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故d错误;
故答案为:bc;
(4)K(300℃)>K(350℃),说明升高温度平衡向逆反应移动,故正反应是放热反应,则25℃时生成1molNO2放出热量为56.4kJ,生成2mol二氧化氮放出热量为112.8kJ,所以该反应的热化学方程式为:2NO(g)+O2(g)?2NO2(g)△H=-112.8kJ/mol,
故答案为:2NO(g)+O2(g)?2NO2(g)△H=-112.8kJ/mol;
(5)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;
b.适当升高温度,反应速率增大,平衡向逆反应移动,故b错误;
c.增大O2的浓度,反应速率增大,平衡向正反应移动,故c正确;
d.选择高效的催化剂,增大反应速率,不影响平衡移动,故d错误;
故选c.
点评 本题考查较为综合,涉及平衡常数的表达式、化学反应速率计算、影响化学平衡的元素与平衡状态的判断等知识,题目难度中等,注意平衡状态判断选择判断的物理量,应随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,试题知识点较多、综合性较强,充分考查了学生的分析能力及灵活应用能力.

| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO2(g)能自发进行,则该反应的△H<0 | |
| C. | 因NaCl溶液和CH3COONH4溶液均显中性,故两溶液中水的电离程度相同 | |
| D. | 用CH3COOH溶液做导电实验,灯泡很暗,一定能证明CH3COOH是弱电解质 |
| 加入 试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验 现象 | 红色固体和 蓝色溶液 | 无色气体 | 无色气体和 蓝色溶液 | 红棕色气体 和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu2O,可能有Cu | D. | 一定有Cu,可能有Cu2O |
| A. | NaBH4既是氧化剂又是还原剂 | |
| B. | NaBH4是氧化剂,H2O是还原剂 | |
| C. | 等物质的量的NaBH4、Na分别与足量水反应,NaBH4生成的氧化产物比Na少 | |
| D. | 被氧化的元素与被还原的元素质量比为1:1 |
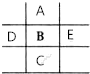 如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )
如图是元素周期表的一部分,已知A、B、C、D、E5种原子核外共有85个电子,其中只有C元素原子次外层电子数为18,则B元素是( )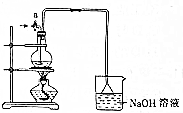 某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.
某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.