题目内容
3.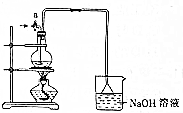 某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.
某化学探究小组为探究能与碳反应的浓硫酸的最低浓度,设计了如图实验装置进行实验.请回答下列问题:
(1)根据图中所示组装实验装置,在加人试剂前需进行的操作是检验装置气密性.
(2)向圆底烧瓶中加人20mL 18mol•L-1硫酸和足量炭粉并加热,烧瓶中发生反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(3)烧杯中盛有足量Na0H溶液,它吸收的物质是CO2、SO2(填化学式);利用倒扣漏斗而不是将导管直接插入溶液,是为了防倒吸.
(4)待烧瓶中反应基本结束,撤去酒精灯,利用余热使反应完全.然后从活塞a处通人足量空气,目的是SO2气体全部进入烧杯中.该实验装置中使用长导管的目的是冷凝回流.
(5)将充分反应后的烧杯取下,向其中加人足量Ba(0H)2溶液和稀硝酸.再经过滤、洗涤、干燥后称得硫酸钡的质量为27.96g,则能与碳反应的硫酸的浓度最低是6mol/L.
分析 有活塞或连接仪器的装置实验前必须检验装置气密性,加热条件下碳和浓硫酸发生C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,因二氧化硫、二氧化碳与氢氧化钠反应,为防止倒吸,吸收装置利用倒扣漏斗而不是将导管直接插入溶液,装置中长导气管兼起导气冷凝的作用,使水蒸气冷凝回流,起到了确保硫酸溶液体积保持不变的作用,以此解答该题.
解答 解:(1)实验装置是制备二氧化硫气体的发生装置,在实验前需要检验装置气密性,防止装置漏气影响实验,故答案为:检验装置气密性;
(2)加热条件下碳和浓硫酸发生C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)反应生成二氧化碳、二氧化硫,可与氢氧化钠溶液反应而被吸收,利用倒置的漏斗而不是将导气管直接伸入烧杯中是防止液体倒吸,故答案为:CO2、SO2;防倒吸;
(4)由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中,装置中长导气管兼起导气冷凝的作用,使水蒸气冷凝回流,起到了确保硫酸溶液体积保持不变的作用,
故答案为:SO2气体全部进入烧杯中;冷凝回流;
(5)加入硝酸把亚硫酸钠氧化为硫酸钠,加入氯化钡溶液反应生成硫酸钡沉淀,通过过滤、洗涤、干燥得到沉淀,称量固体的质量为27.96g为硫酸钡沉淀,物质的量=$\frac{27.96g}{233g/mol}$=0.12mol,依据硫元素守恒,被氧化的硫酸为0.12mol,依据化学方程式可知,C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,反应的硫酸物质的量为0.24mol,剩余硫酸物质的量=18mol/L×0.020L-0.24mol=0.12mol,需要的最低浓度=$\frac{0.12mool}{0.02L}$=6mol/L,
故答案为:过滤、洗涤、干燥;6mol/L.
点评 本题以浓硫酸和Cu的反应为载体考查性质实验方案设计,为高频考点,涉及基本计算、基本操作、氧化还原反应等知识点,明确实验基本操作、物质性质是解本题关键,注意实验的评价,难点是(5)题分析解答.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |

回答下列问题:
(1)根据实验目的,接口连接的顺序为1-4-5-2-3-6-710-9-8
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为NaOH溶液.
(3)A装置中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)B装置中发生反应的化学方程式为3Cl2+NH4Cl═NCl3+4HCl,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为71~95℃.
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象:NCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$3HClO+NH3;NCl3本身无漂白性;NCl3在热水中水解生成NH3•H2O使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色..

| A. | 47.87是丰度最高的钛原子的相对原子质量 | |
| B. | 钛原子的M层上共有10个电子 | |
| C. | 从价电子构型看,钛属于某主族元素 | |
| D. | 22为钛原子的质量数 |
| A. | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32-不能大量共存,因有Al2(CO3)3沉淀生成 | |
| B. | 含大量Fe3+的溶液中:K+Mg2+、I-、Br2-不能大量共存,因2Fe3++2I-=2Fe2++I2 | |
| C. | 由水电离的c(H+)=1×10-14mol/L的溶液中:Ca2+、NO3-、HCO3-、Cl-不能大量共存,因溶液呈酸性,与HCO3-反应产生CO2气体 | |
| D. | 在NH4Fe(SO4)2溶液中:Na+、K+、S2-、SCN-不能大量共存,只是因Fe3+和S2-反应产生淡黄色的S沉淀 |
| A. | 向MgCl2溶液中加入过量的NaOH溶液,Mg2+沉淀完全,则溶液中不含Mg2+ | |
| B. | Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小 | |
| C. | 25℃时,由于Kw(ZnS)>Kw(CuS),所以ZnS在一定条件下可转化为CuS | |
| D. | 0.1molAgCl和0.1molAgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
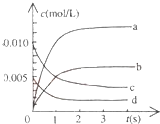 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s)
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)某同学查阅资料得知,该反应K300℃>K350℃;25℃时,生成1molNO2,热量变化为56.4kJ.但是该同学由于疏忽,忘记注明“+”、“-”.根据题目信息,该反应的热化学方程式为2NO(g)+O2(g)?2NO2(g)△H=-112.8kJ/mol.
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂.
