题目内容
3.将0.01 mol钠投人含0.1 mol硫酸的1L溶液中,假设反应后溶液的体积还是1L,生成气体的物质的量为x mol,溶液中氢离子浓度为y mol•L-1,则下列计算结果正确的是( )| A. | x=0.005,y=0.1 | B. | x=0.005,y=0.18 | C. | x=0.01,y=0.18 | D. | x=0.005,y=0.19 |
分析 钠与硫酸反应反应:2Na+H2SO4=Na2SO4+H2↑,由方程式可知0.01molNa完全反应消耗0.005mol硫酸,则硫酸过量,根据方程式计算生成氢气物质的量,进而计算溶液中氢离子浓度.
解答 解:钠与硫酸反应反应:2Na+H2SO4=Na2SO4+H2↑,由方程式可知0.01molNa完全反应消耗硫酸为0.01mol×$\frac{1}{2}$=0.005mol<0.1mol,则硫酸过量,则:
2Na+H2SO4=Na2SO4+H2↑
2 1
0.01mol x
所以x=$\frac{0.01mol}{2}$=0.005mol,
反应后溶液中氢离子浓度为$\frac{(0.1mol-0.005mol)×2}{1L}$=0.19mol/L,
故选:D.
点评 本题考查化学方程式有关计算,涉及过量计算,注意若硫酸不足时钠能与水反应生成氢氧化钠,需要计算氢氧化钠的浓度,再结合水的离子积计算溶液氢离子浓度.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
13.“塑料王”的耐热性和化学稳定性均超过其他塑料,合成路线如下:

下列说法中,错误的是( )

下列说法中,错误的是( )
| A. | “塑料王”是高分子材料 | |
| B. | 二氟一氯甲烷的分子中只含共价键 | |
| C. | 聚四氟乙烯中碳原子均在同一直线上,形成链状高分子 | |
| D. | 四氟乙烯(CF2=CF2)中所有的原子都在同一个平面上 |
11.在实验室里,下列除去杂质的方法正确的是 ( )
| A. | 溴苯中混有溴,加入KI溶液,充分振荡,静置后再分液 | |
| B. | 乙烷中混有乙烯,通入过量氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓硝酸和浓硫酸,加入NaOH溶液中,充分振荡,静置后分液 | |
| D. | 乙烷中混有CO2,将其通入饱和NaHCO3溶液中洗气. |
18.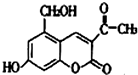 某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图.关于“亮菌甲素”的说法中,正确的是( )
某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图.关于“亮菌甲素”的说法中,正确的是( )
 某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图.关于“亮菌甲素”的说法中,正确的是( )
某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图.关于“亮菌甲素”的说法中,正确的是( )| A. | “亮菌甲素”的分子式为C12H10O5 | |
| B. | 1mol“亮菌甲素”与溴水的反应,最多消耗3mol Br2 | |
| C. | 1mol“亮菌甲素”最多能和6mol H2发生加成反应 | |
| D. | 1mol“亮菌甲素”最多能和2mol NaOH反应 |
8.某元素X,它的原子最外层电子数是次层电子数的3倍,则X在周期表中位于( )
| A. | 第三周期 | B. | 第二周期 | C. | ⅣA族 | D. | ⅤA族 |
7.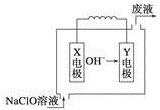 燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )
 燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )| A. | 电池工作时,Na+向负极移动 | |
| B. | 镁作Y电极 | |
| C. | 废液的pH大于NaClO溶液的pH | |
| D. | X电极上发生的反应为ClO-+2H2O-4e-═ClO3-+4H+ |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 等质量的二氧化硫和氨气,前者体积大 | |
| B. | 标况下22.4升 HCl通入水中溶液中含氯化氢分子为0.1 mol | |
| C. | 任何条件下相同物质的量的两种气体含有相同数目的分子 | |
| D. | 标况下2 molH2的摩尔质量是4g/mol |
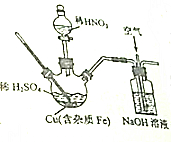 磷酸铜可用作镀铜离子添加剂,实验室在如图所示装(夹持、加热装置省去未画)内反应生成了硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体,请回答下列问题:
磷酸铜可用作镀铜离子添加剂,实验室在如图所示装(夹持、加热装置省去未画)内反应生成了硫酸铜和少量硫酸铁,再进一步从所得溶液中获得硫酸铜晶体,请回答下列问题: