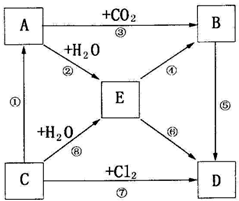
题目内容
7.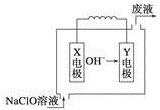 燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )| A. | 电池工作时,Na+向负极移动 | |
| B. | 镁作Y电极 | |
| C. | 废液的pH大于NaClO溶液的pH | |
| D. | X电极上发生的反应为ClO-+2H2O-4e-═ClO3-+4H+ |
分析 原电池工作时,阴离子向负极移动,阳离子向正极移动,由阴离子移动方向可知Y为负极,X为正极,负极发生氧化反应,正极发生还原反应,以此解答该题.
解答 解:A.Na+移向流入电子的正极或X电极,故A错误;
B.Mg容易失去电子,OH-在燃料电池中移向流出电子的负极,故Mg作Y电极,故B正确;
C.镁失去2个电子变为镁离子,镁离子与氢氧根离子结合为氢氧化镁沉淀,OH-被消耗,反应后废液的主要成分为氯化钠,故废液的pH小于 NaClO溶液的pH,故C错误;
D.碱性条件下,不能生成氢离子,则正极反应式为ClO-+2e-+H2O=Cl-+2OH-,故D错误.
故选B.
点评 本题综合考查电解池和原电池知识,侧重于学生的分析能力的考查,注意把握电极方程式的书写,为解答该类题目的关键,题目难度不大.

练习册系列答案
相关题目
5.下列变化属于物理变化的是( )
| A. | 漂粉精露置在空气中变质 | B. | 食物腐败 | ||
| C. | 新制氯水放置一段时间后颜色变浅 | D. | 用四氯化碳萃取溴水中的溴 |
3.将0.01 mol钠投人含0.1 mol硫酸的1L溶液中,假设反应后溶液的体积还是1L,生成气体的物质的量为x mol,溶液中氢离子浓度为y mol•L-1,则下列计算结果正确的是( )
| A. | x=0.005,y=0.1 | B. | x=0.005,y=0.18 | C. | x=0.01,y=0.18 | D. | x=0.005,y=0.19 |
19.图是铜锌原电池示意图.当该原电池工作时,下列描述不正确的是( )


| A. | 铜片上有气泡产生 | B. | 锌片逐渐溶解 | ||
| C. | 溶液逐渐变蓝 | D. | 电流计指针发生偏转 |
17.将Mg、Cu组成的26.4g混合物投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入足量的4mol•L-1的NaOH溶液,使金属离子完全沉淀.则形成沉淀的质量是( )
| A. | 43.2 g | B. | 46.8 g | C. | 53.6 g | D. | 63.8 g |
 、
、 .
.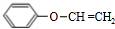 .
.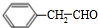 、
、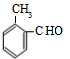 、
、 、
、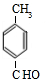 .
.