题目内容
2.下列反应的离子方程式书写正确的是( )| A. | 锌粒与稀硝酸反应:Zn+2 H+═Zn2++H2↑ | |
| B. | 醋酸与氨水反应:CH3COOH+NH3•H2O═CH3COONH4+H2O | |
| C. | NH4Al(SO4)2与足量NaOH稀溶液反应5OH-+NH4++Al3+═AlO2-+NH3•H2O+2H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
分析 A.稀硝酸具有强氧化性,锌与稀硝酸反应生成NO气体,不会生成氢气;
B.醋酸铵为强电解质,离子方程式中应该拆开;
C.氢氧化钠足量,铵根离子、铝离子完全反应,
D.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒.
解答 解:A.锌与稀硝酸反应生成硝酸锌、一氧化氮气体和水,正确的离子方程式为:3Zn+2NO3-+8H+=3Zn2++2NO+4H2O,故A错误;
B.醋酸与氨水反应生成醋酸铵和水,醋酸铵应该拆开,正确的离子方程式为:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O,故B错误;
C.NH4Al(SO4)2与足量NaOH稀溶液反应,铵根离子和铝离子都完全反应,反应的离子方程式为:5OH-+NH4++Al3+═AlO2-+NH3•H2O+2H2O,故C正确;
D.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意明确离子方程式判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
16.下列关于化学反应的自发性叙述中正确的是( )
| A. | △H>0、△S>0的反应肯定是自发的 | B. | △H>0、△S<0的反应肯定是自发的 | ||
| C. | △H<0、△S>0的反应肯定是自发的 | D. | △H<0、△S<0的反应高温时是自发的 |
14.反应4NH3(气)+5O2(气)?4NO(气)+6H2O(气)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率$\overline v$(X)可表示为( )
| A. | $\overline v$(NH3)=0.0100mol?L-1?s-1 | B. | $\overline v$(O2)=0.0010mol?L-1?s-1 | ||
| C. | $\overline v$(NO)=0.0010mol?L-1?s-1 | D. | $\overline v$(H2O)=0.045mol?L-1?s-1 |
11.将0.20mol•L-1的NH3•H2O溶液和0.10mol•L-1的HCl溶液等体积混合,充分反应后,下列有关该溶液中各粒子浓度的关系不正确的是( )
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(Cl-)+c(OH-) | ||
| C. | c(NH4+)+c(NH3•H2O)=0.10mol•L-1 | D. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
12.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | NaHSO4 和 Ba(OH)2 | B. | NaAlO2和HCl | C. | Na2CO3和 HCl | D. | AlCl3和 NaOH |
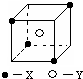 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: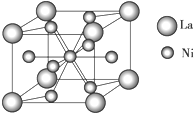 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题: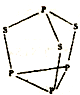 己知A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D原子核外电子排布为nsnnpn+2,E是第四周期元素,最外层只有一个电子,其余各层电子均充满.
己知A、B、C、D、E五种元素,均位于周期表的前四周期,它们的核电荷数依次增加.A元素核内只有质子,B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D原子核外电子排布为nsnnpn+2,E是第四周期元素,最外层只有一个电子,其余各层电子均充满.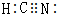 .
.