题目内容
10.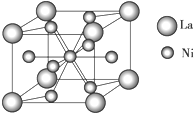 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:(1)Ni原子的核外电子排布式为1s22s22p63s23p63d84s2;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO>FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为6、6;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示.该合金的化学式为LaNi5.
分析 (1)镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式;
(2)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(3)因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6;
(4)晶胞中镧原子数=8×$\frac{1}{8}$=1;镍原子数=1+8×$\frac{1}{2}$=5,由此可判断出化学式.
解答 解:(1)镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式,Ni的核外电子排布式是1s22s22p63s23p63d 84s2,
故答案为:1s22s22p63s23p63d 84s2;
(2)Ni0、Fe0的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,
故答案为:>;
(3)因为Ni0、Fe0的晶体结构类型均与氯化钠的相同,而氯化钠中阴阳离子的配位数均为6,所以Ni0晶胞中Ni和O的配位数也均为6,
故答案为:6;6;
(4)晶胞中镧原子数8×$\frac{1}{8}$=1;镍原子数=1+8×$\frac{1}{2}$=5,所以该合金的化学式为:LaNi5,
故答案为:LaNi5.
点评 本题考查晶体的结构与物质的性质的相互关系及应用,做题时注意电子排布式的书写方法,晶体熔点比较发放,分子空间构型的判断方法以及晶胞的有关计算,注意学习中有关做题方法的积累.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
4.已知在3.2g某气体中所含的分子数目约为3.01×1022,此气体的摩尔质量为( )
| A. | 32g | B. | 32g/mol | C. | 64 mol | D. | 64g/mol |
1.已知X、Y、Z、W为原子序数依次增大的短周期主族元素,Z+与X3-具有相同的电子层结构,Y、W原子的价电子数目之和为13.下列有关说法中正确的是( )
| A. | 四种元素的原子半径:Z<Y<X<W | |
| B. | 化合物Z2Y与ZW中的化学键类型相同 | |
| C. | X与W两种元素的最简单氢化物间能发生化合反应 | |
| D. | 常温下,X和Y形成的所有化合物均为无色气体 |
18.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到2mol乙酸和1mol醇,该醇的分子式为( )
| A. | C14H18O5 | B. | C14H22O3 | C. | C14H22O5 | D. | C14H10O5 |
2.下列反应的离子方程式书写正确的是( )
| A. | 锌粒与稀硝酸反应:Zn+2 H+═Zn2++H2↑ | |
| B. | 醋酸与氨水反应:CH3COOH+NH3•H2O═CH3COONH4+H2O | |
| C. | NH4Al(SO4)2与足量NaOH稀溶液反应5OH-+NH4++Al3+═AlO2-+NH3•H2O+2H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
19.有机化合物的 核磁共振氢谱有个峰( )
核磁共振氢谱有个峰( )
 核磁共振氢谱有个峰( )
核磁共振氢谱有个峰( )| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
 材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展.
材料的开发、应用和发展是科技进步的结果,同时,材料的发展也促进了科技的进步和发展. .
. 、
、 ,D、E形成的化合物
,D、E形成的化合物 .
.