题目内容
17.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,11.2LHF中含有H-F键的数目为0.5NA |
分析 A.18O2分子中含有20个中子,根据n=$\frac{m}{M}$计算出该氧气的物质的量,然后计算出含有的中子数;
B.Cu2S和CuO混合物Cu的质量分数相等,据此计算出混合物中含有Cu的质量,然后根据n=$\frac{m}{M}$计算出含有铜的物质的量;
C.不是标准状况下,不能使用标准状况下的气体摩尔体积计算;
D.标准状况下,氟化氢的状态不是气体.
解答 解:A.36g18O2物质的量为:$\frac{36g}{36g/mol}$=1mol,1mol该氧气分子中含有20mol中子,含有的中子数为20NA,故A错误;
B.Cu2S和CuO混合物Cu的质量分数相等,含Cu的质量为:8.0g×$\frac{64}{80}$=6.4g,含有Cu的物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,含有Cu原子个数为0.1NA,故B正确;
C.阳极生成的为氧气,不是标准状况下,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.HF在标况下为液体,无法计算HF物质的量,故D错误;
故选B.
点评 本题考查物质的量的有关计算,题目难度中等,注意明确标准状况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生的化学计算能力.

练习册系列答案
相关题目
9.在25℃时,将a mol/L的氨水与0.01mol/L的HCl溶液等体积混合,反应后溶液呈中性,下列说法不正确的是(忽略溶液混合后体积的变化)( )
| A. | 此时水的电离程度最大 | |
| B. | 溶液中c(NH${\;}_{4}^{+}$)=c(Cl-) | |
| C. | 此时溶液中NH3•H2O的物质的量浓度为$\frac{1}{2}$(a-0.01)mol/L | |
| D. | 用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
6.甲醇、空气和强碱溶液做电解质的手机燃料电池中所发生的反应为:2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,下列有关说法正确的是( )
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol | |
| C. | 放电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,负极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
 .
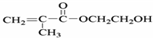
. CH3OH+CH2=C(CH3)COOH.
CH3OH+CH2=C(CH3)COOH.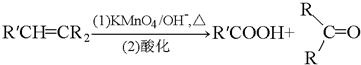
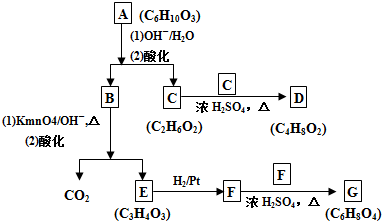
 C:CH2OHCH2OH
C:CH2OHCH2OH E:
E: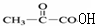
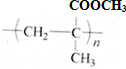 .
.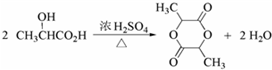 .
.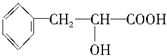
 (只要求写出一个化学方程式,有机物写结构简式).
(只要求写出一个化学方程式,有机物写结构简式).