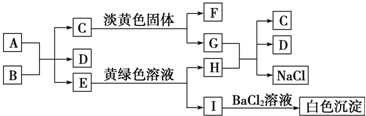
题目内容
12.实验室配制CuSO4溶液时常加入少量H2SO4,其作用是抑制Cu2+水解,防止溶液浑浊.在CuSO4溶液中加入适量NaOH溶液后,再滴加甲醛溶液,加热,可观察到的现象是产生砖红色沉淀,加热时反应的化学方程式是HCHO+4Cu(OH)2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+2Cu2O↓+6H2O,此反应可用于检验醛基 的存在.分析 硫酸铜溶液中铜离子在水溶液中水解使配制的溶液变浑浊,加入少量H2SO4 可以抑制离子的铜水解,在CuSO4溶液中加入适量NaOH溶液后,得到新制的氢氧化铜悬浊液,再滴加甲醛溶液,加热发生氧化还原反应,甲醛被氧化为碳酸分解生成二氧化碳,在碱溶液中生成碳酸钠,同时生成红色氧化亚铜沉淀,是检验醛基存在的特征现象.
解答 解:实验室配制CuSO4溶液时常加入少量H2SO4,硫酸铜溶液中铜离子在水溶液中水解使配制的溶液变浑浊,所以加入少量H2SO4 可以抑制离子的铜水解,在CuSO4溶液中加入适量NaOH溶液后,得到新制的氢氧化铜悬浊液,再滴加甲醛溶液,加热发生氧化还原反应,甲醛被氧化为碳酸分解生成二氧化碳,在碱溶液中生成碳酸钠,同时生成砖红色氧化亚铜沉淀,反应的化学方程式为:HCHO+4Cu(OH)2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+2Cu2O↓+6H2O,是检验醛基存在的特征现象,
故答案为:抑制Cu2+水解,防止溶液浑浊;产生砖红色沉淀;HCHO+4Cu(OH)2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+2Cu2O↓+6H2O; 醛基.
点评 本题考查了盐类水解的应用,配制溶液的方法防止氧化,防止水解的方法应用、醛基检验和现象的判断,理解实质是解题关键,题目难度中等.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
2.下列分子或离子中,不含孤电子对的是( )
| A. | H2O | B. | H3O+ | C. | NH3 | D. | NH${\;}_{4}^{+}$ |
20.下列说法正确的是( )
| A. | 1L水中溶解了58.5g NaCl,该溶液的物质的量浓度为1mol/L | |
| B. | V L Fe2(SO4)3溶液中含a g SO42-,取此溶液$\frac{V}{2}$ L用水稀释成2V L,则稀释后溶液的c(Fe3+)为$\frac{a}{576V}$ mol/L | |
| C. | 已知某NaCl溶液的密度是1.17 g/cm3,可求出此溶液的物质的量浓度 | |
| D. | 把100mL20%的NaOH溶液跟100mL10%的NaOH 混合后,可判断NaOH混合溶液的质量分数等于15% |
7.X为下列各选项物质,X不能满足如图转化关系的是( )


| A. | H2S | B. | N2 | C. | S | D. | NH3 |
17.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,11.2LHF中含有H-F键的数目为0.5NA |
4.根据下图,可判断出下列离子方程式中错误的是( )
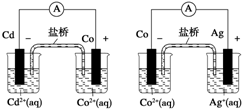

| A. | 2Ag+(aq)+Cd(s)═2Ag(s)+Cd2+(aq) | B. | Co2+(aq)+Cd(s)═Co(s)+Cd2+(aq) | ||
| C. | 2Ag(s)+Cd2+(aq)═2Ag+(aq)+Cd(s) | D. | 2Ag+(aq)+Co(s)═2Ag(s)+Co2+(aq) |
2.下列实验操作正确的是( )
| A. | 配制银氨溶液:向2%的稀氨水中滴入2%的硝酸银溶液,配得银氨溶液 | |
| B. | 实验室制硝基苯:试剂顺序--先加浓H2SO4,再加浓HNO3混合冷却后,最后加苯 | |
| C. | 检验卤代烃消去反应的有机产物:溴乙烷和NaOH的乙醇溶液混合后加热,将产生的蒸汽直接通入酸性高锰酸钾溶液,观察是否褪色 | |
| D. | 鉴别矿物油和植物油:向汽油和植物油中分别加入一定量NaOH溶液加热振荡,观察油层是否消失或变薄 |