题目内容
4.医学界通过用放射性14C标记的14C标记的C60发现一种C60的羧酸衍生物在特定条件下可以通过断裂DNA杀死细胞,则有关14C的叙述正确的是( )| A. | 与C60中普通碳原子的化学性质不同 | |
| B. | 与14N含的中子数相同 | |
| C. | 与12C为相同核素 | |
| D. | 与12C互为同位素 |
分析 A.碳原子的化学性质相同;
B.中子数=质量数-质子数;
C.同素异形体为同种元素的不同单质;
D.质子数相同,中子数不同的原子互为同位素.
解答 解:A.15C与C60中普通碳原子,为同种元素的碳原子,则碳原子的化学性质相同,故A错误;
B.14C的中子数为14-6=8,14N的中子,14-7=7,二者不同,故B错误;
C.14C为原子,质量数14,12C为原子质量数为12,是不同核素,故C错误;
D.14C与12C的质子数均为6,中子数不同,互为同位素,故D正确;
故选D.
点评 本题考查原子的构成及原子中的数量关系,明确质量数、质子数、中子数的关系及同位素、同素异形体即可解答,题目难度不大.

练习册系列答案
相关题目
15.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙醇可被重铬酸钾氧化成乙酸,溶液由橙色变成绿色 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
12.“海绵镍铝催化剂”是一种多孔的镍铝合金,常用作有机催化剂.现以某粗镍(含Ni、Fe、Cu及难与酸、碱溶液反应的不溶性杂质)为原料制取该催化剂,主要流程如图

:25℃时,以0.1mol/L金属离子测定得到如表数据:
根据信息回答:
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式Ni+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NiSO4+SO2↑+2H2O.
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是温度超过100℃后,Ni2+的水解程度变大,生成更多Ni(OH)2.

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物.为达到此目的,应先加NaOH将溶液调节至6.7≤pH<7.2(填pH的取值范围);再加_D(选填最佳试剂的序号).当溶液中Ni2+开始形成NiS时,c(Cu2+)1.6×10-17mol/L.(忽略溶液体积变化)
A.硝酸 B.氨水 C.A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为0;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni.ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为ClO-+2Ni2++4OH-=2NiOOH+H2O+Cl-.
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.

:25℃时,以0.1mol/L金属离子测定得到如表数据:
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS | Fe(OH)3 | |
| Ksp | 6×10-36 | 3×10-19 | ||||
| pH | 开始沉淀 | 4.7 | 7.2 | 1.9 | ||
| 沉淀完全 | 6.7 | 9.2 | 3.2 | |||
(1)步骤①常用热浓硫酸进行酸浸,写出酸浸时金属镍发生反应的化学方程式Ni+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$NiSO4+SO2↑+2H2O.
(2)酸浸过程应控制酸的浓度、温度等条件,如图是镍的浸出率与温度的关系,温度高于100℃时,Ni2+浸出率降低的原因可能是温度超过100℃后,Ni2+的水解程度变大,生成更多Ni(OH)2.

(3)滤液l中含有0.8mol/LNi2+、0.1mol/LFe3+、0.1mol/LCu2+,步骤②的连续操作过程需要先分离出铁元素、铜元素,再制得镍硫化合物.为达到此目的,应先加NaOH将溶液调节至6.7≤pH<7.2(填pH的取值范围);再加_D(选填最佳试剂的序号).当溶液中Ni2+开始形成NiS时,c(Cu2+)1.6×10-17mol/L.(忽略溶液体积变化)
A.硝酸 B.氨水 C.A12S3 D.H2S
(4)步骤③生成的Ni(CO)4中碳的化合价与KCN中碳的化合价相同,则Ni(CO)4中Ni的化合价为0;工业上也常用NaClO氧化NiSO4,将制得的NiOOH热分解后进行还原得到Ni.ClO-在碱性条件下氧化Ni2+生成NiOOH的离子方程式为ClO-+2Ni2++4OH-=2NiOOH+H2O+Cl-.
(5)步骤⑥的目的是降低铝含量、获得多孔状的“海绵镍铝催化剂”,从而增强对氢气的吸附性,步骤⑥的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
19.标准状况下,11.2LCO2中所含的CO2分子数为( )
| A. | 3.01×1023 | B. | 6.02×1023 | C. | 0.5 | D. | 0.25 |
16.下列说法正确的是( )
| A. | 1mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2并加热 | |
| D. | 油脂不是高分子化合物,1mol油脂完全水解生成1mol甘油和3mol高级脂肪酸 |
13.下列反应中,反应物总能量低于生成物总能量,且属于氧化还原反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 灼热的炭与CO2反应 | ||
| C. | 铝与稀盐酸 | D. | 铝粉与氧化铁粉末反应 |
14.如图是滴定管和量筒的两个液面.下列有关读数中正确的是( )
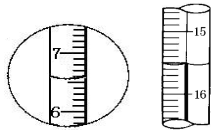

| A. | 左边是量筒读数6.5mL,右边是滴定管读数16.50mL | |
| B. | 左边是量筒读数7.5mL,右边是滴定管读数16.50mL | |
| C. | 左边是量筒读数6.5mL,右边是滴定管读数15.50mL | |
| D. | 左边是量简读数6.5mL,右边是滴定管读数16.50mL |
 现有如下两个反应:①NaOH+HCl═NaCl+H2O;②2H2+O2═2H2O.
现有如下两个反应:①NaOH+HCl═NaCl+H2O;②2H2+O2═2H2O.