题目内容
16.下列说法正确的是( )| A. | 煤的气化是物理变化 | |
| B. | 蛋白质的基本结构单元是氨基酸 | |
| C. | 在蛋白质溶液中加入CuSO4溶液,可使蛋白质的溶解度降低而析出 | |
| D. | 乙醛、葡萄糖、淀粉都能与新制的银氨溶液发生反应 |
分析 A.煤的气化生成CO和氢气;
B.蛋白质水解可生成氨基酸;
C.蛋白质在硫酸铜溶液中发生变性;
D.淀粉与银氨溶液不反应.
解答 解:A.煤的气化生成CO和氢气,为化学变化,故A错误;
B.蛋白质水解可生成氨基酸,所以蛋白质的基本结构单元是氨基酸,故B正确;
C.重金属盐可使蛋白质变性,故C错误;
D.淀粉为非还原性糖,与银氨溶液不反应,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力和双基的考查,注意把握常见有机物的组成、结构以及官能团的性质,难度不大.

练习册系列答案
相关题目
1. 短周期元素A、B、C、D的原子序数依次增大,它们在元素周期表中的相对位置如图所示,已知C和A的原子序数之差等于A的原子序数,下列说法正确的是( )
短周期元素A、B、C、D的原子序数依次增大,它们在元素周期表中的相对位置如图所示,已知C和A的原子序数之差等于A的原子序数,下列说法正确的是( )
 短周期元素A、B、C、D的原子序数依次增大,它们在元素周期表中的相对位置如图所示,已知C和A的原子序数之差等于A的原子序数,下列说法正确的是( )
短周期元素A、B、C、D的原子序数依次增大,它们在元素周期表中的相对位置如图所示,已知C和A的原子序数之差等于A的原子序数,下列说法正确的是( )| A. | 原子半径:D>C>B>A | |
| B. | 简单离子半径:D>A>B | |
| C. | 简单氢化物的稳定性:D>C>A | |
| D. | 四种元素的最高价氧化物均可溶于水 |
7.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A. | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
| B. | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C. | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D. | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
4.煤燃烧排放的烟含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
(1)NaClO2的化学名称为亚氯酸钠.
(2)在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表.
①写出NaClO2溶液脱硝过程中主要反应的离子方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O.增加压强,NO的转化率提高(填“提高”、“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压Pe如图所示.
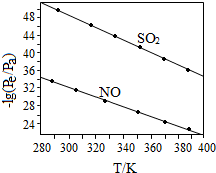
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均减小(填“增大”、“不变”或“减小”).
②反应ClO2-+2SO32-═2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-}){c}^{2}(S{{O}_{4}}^{2-})}{c(Cl{{O}_{2}}^{-}){c}^{2}(S{{O}_{3}}^{2-})}$.
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高.
②已知下列反应:
SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq)的△H=△H1+△H2-△H3.
(1)NaClO2的化学名称为亚氯酸钠.
(2)在鼓泡反应器中通入含SO2、NOx的烟气,反应温度323K,NaClO2溶液浓度为5×10-3mol•L-1.反应一段时间后溶液中离子浓度的分析结果如表.
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
②随着吸收反应的进行,吸收剂溶液的pH逐渐减小(填“增大”、“不变”或“减小”).
③由实验结果可知,脱硫反应速率大于脱硝反应速率(填“大于”或“小于”)原因是除了SO2和NO在烟气中初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高.
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压Pe如图所示.

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均减小(填“增大”、“不变”或“减小”).
②反应ClO2-+2SO32-═2SO42-+Cl-的平衡常数K表达式为$\frac{c(C{l}^{-}){c}^{2}(S{{O}_{4}}^{2-})}{c(Cl{{O}_{2}}^{-}){c}^{2}(S{{O}_{3}}^{2-})}$.
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果.
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高.
②已知下列反应:
SO2(g)+2OH-(aq)═SO32-(aq)+H2O(l)△H1
ClO-(aq)+SO32-(aq)═SO42-(aq)+Cl-(aq)△H2
CaSO4(s)═Ca2+(aq)+SO42-(aq)△H3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)═CaSO4(s)+H2O(l)+Cl-(aq)的△H=△H1+△H2-△H3.
11.室温下,下列各选项中所述的两个量,前者一定大于后者的是( )
| A. | pH=10的NaOH溶液和pH=4的盐酸溶液中,水的电离程度 | |
| B. | 将pH=3的盐酸和醋酸分别稀释成pH=5的溶液,需加水的体积 | |
| C. | 10mL0.1mol•L-1的醋酸与100mL0.01mol•L-1的醋酸中的H+物质的量 | |
| D. | 等体积pH相等的醋酸和盐酸,分别与过量的锌粉反应产生的H2的质量 |
1.仅能在水溶液中导电的电解质是( )
| A. | KOH | B. | KNO3 | C. | NH4HCO3 | D. | 酒精 |
8.若烃(CxH2x-6)符合下列两个条件,则烃(CxH2x-6)的一氯代物共有(不考虑立体异构)( )
①1个CxH2x-6分子中碳与氢原子之间形成8个共价键
②烃(CxH2x-6)中含一个苯环.
①1个CxH2x-6分子中碳与氢原子之间形成8个共价键
②烃(CxH2x-6)中含一个苯环.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
13.下列对氨基酸和蛋白质的描述正确的是( )
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 氨基酸和蛋白质遇重金属离子均会变性 | |
| C. | α-氨基丙酸与α-氨基苯丙酸混合物脱水成肽,只生成2种二肽 | |
| D. | 氨基酸溶于过量氢氧化钠溶液中生成的离子,在电场作用下向负极移动 |
14.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
则:
(1)硝酸的浓度为多大?
(2)每份金属的质量为多少?
(3)编号④中最多产生的气体积V为多少升?(该问答案取整数)
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 12.2 | 3.2 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
(1)硝酸的浓度为多大?
(2)每份金属的质量为多少?
(3)编号④中最多产生的气体积V为多少升?(该问答案取整数)