题目内容
14.孔雀石的主要成分为Cu2(OH)2CO3,还含少量二价铁和三价铁的氧化物及硅的氧化物.以下是实验室以孔雀石为原料制备CuSO4•5H2O晶体的流程图: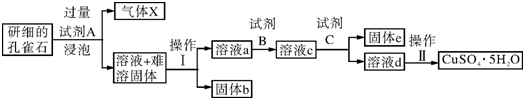
(1)试剂A的化学式是H2SO4;操作Ⅰ的名称是过滤;
(2)生成气体X的化学方程式为:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑.
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用B
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)已知:
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
②为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为3.7-4.8.
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论)取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去.
分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物,将孔雀石研磨然后加入试剂A浸泡,得到气体、溶液和固体,因为最终得到CuSO4,且能得到气体,试剂A为稀硫酸,Cu2(OH)2CO3、铁的氧化物都能和稀硫酸反应生成硫酸盐,SiO2和稀硫酸不反应,所以X为CO2、溶液中溶质为CuSO4、铁的硫酸盐,过滤得到固体b为SiO2;试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B应该具有强氧化性,能氧化亚铁离子但不能引进新的杂质,所以B为双氧水;
试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离,加入的物质能和稀硫酸反应,能将铁离子转化为沉淀,但不能引进新的杂质;然后过滤得到固体e和溶液d,将溶液d加热浓缩、冷却结晶、过滤得到五水硫酸铜,据此分析解答.
解答 解:孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物,将孔雀石研磨然后加入试剂A浸泡,得到气体、溶液和固体,因为最终得到CuSO4,且能得到气体,试剂A为稀硫酸,Cu2(OH)2CO3、铁的氧化物都能和稀硫酸反应生成硫酸盐,SiO2和稀硫酸不反应,所以X为CO2、溶液中溶质为CuSO4、铁的硫酸盐,过滤得到固体b为SiO2;试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B应该具有强氧化性,能氧化亚铁离子但不能引进新的杂质,所以B为双氧水;
试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离,加入的物质能和稀硫酸反应,能将铁离子转化为沉淀,但不能引进新的杂质;然后过滤得到固体e和溶液d,将溶液d加热浓缩、冷却结晶、过滤得到五水硫酸铜,
(1)通过以上分析知,A为H2SO4,分离难溶性固体和溶液采用过滤方法,故答案为:H2SO4;过滤;
(2)生成X的方程式为Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑,故答案为:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑;
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,但不能引进新的杂质,所以试剂B最好选用双氧水,故选B;
(4)试剂C的使用是为了调节溶液的pH,且不能引进新的杂质,且易分离,使Fe3+转化为沉淀予以分离CuO,故选D;
②将铁离子转化为沉淀但铜离子不能转化为沉淀,所以pH范围为3.7-4.8,故答案为:3.7~4.8;
(5)铁离子的检验方法为取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去,故答案为:取待检溶液少许,加入KSCN溶液,若溶液不变红色,说明Fe3+已完全除去;若溶液变红色,则说明Fe3+未完全除去.
点评 本题考查物质分离和提纯,为高频考点,涉及试剂的选取、基本实验操作、除杂等知识点,明确实验原理是解本题关键,知道每个过程发生的反应及基本操作方法,注意选取试剂时不能引进新的杂质,注意是利用氢氧化铁溶解度受pH的影响选取试剂,而不是直接用铁离子和氢氧根离子反应生成氢氧化铁,为易错点.

 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 因地制宜开发利用风能、水能、地热能、潮汐能 | |
| B. | 大力推广并充分利用太阳能 | |
| C. | 合理、安全开发利用氢能、核能 | |
| D. | 能源都是通过化学反应获得的 |
| A. | 氧化还原反应的判断依据是看反应前后元素化合价是否发生变化 | |
| B. | 根据是否只含一种元素将物质分为纯净物和混合物 | |
| C. | 根据水溶液是否能导电将化合物分为电解质和非电解质 | |
| D. | 根据是否有丁达尔现象将分散系分为溶液和胶体 |
| A. | ${\;}_{6}^{12}C$、${\;}_{6}^{13}C$、${\;}_{6}^{14}C$及金刚石、石墨都是碳的同位素 | |
| B. | 同位素的原子的物理性质、化学性质相同 | |
| C. | 同位素原子的本质区别在于质量数不同 | |
| D. | 质子数相同,中子数不同的原子互为同位素 |
| 选项 | 氯水滴入下列溶液中 | 实验现象 | 结论 |
| A | 滴有KSCN的FeC12溶液 | 变红 | C12具有还原性 |
| B | 滴有石蕊的NaOH溶液 | 褪色 | C12具有酸性 |
| C | 紫色石蕊溶液 | 先变红后褪色 | C12具有漂白性 |
| D | KI淀粉溶液 | 变蓝 | C12具有氧化性 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  O3转变为O2能量曲线可用图表示 | |
| B. | O3转变为O2为氧化还原反应 | |
| C. | 臭氧层中氟里昂释放出的氯原子是O3分解的催化剂 | |
| D. | t℃时,3O2(g)?2O3(g),K′≈3.33×10-77 |